
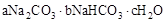 (a、b、c为整数)表示。现有A、B两种不同的天然碱样品,分别进行如下实验以确定其化学式。
(a、b、c为整数)表示。现有A、B两种不同的天然碱样品,分别进行如下实验以确定其化学式。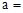
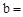
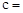
 NaCl+NaHCO3 NaHCO3+HCl
NaCl+NaHCO3 NaHCO3+HCl NaCl+CO2↑+H2O
NaCl+CO2↑+H2O| 盐酸体积(mL) | 20 | 40 | 60 | 80 |
| 产生气体体积(mL) | 0 | 560 | 1680 | 2520 |
 Na2CO3+CO2↑+H2O 这个原理。由题意可知n(CO2)=0.1 mol。
Na2CO3+CO2↑+H2O 这个原理。由题意可知n(CO2)=0.1 mol。 Na2CO3+ CO2↑+ H2O
Na2CO3+ CO2↑+ H2O ,m(H2O)="0.2" mol×18 g·mol-1="3.6" g,m(Na2CO3)=31 g-16.8 g-3.6 g=10.6 g,
,m(H2O)="0.2" mol×18 g·mol-1="3.6" g,m(Na2CO3)=31 g-16.8 g-3.6 g=10.6 g, 。由此可知晶体中n(Na2CO3)∶n(NaHCO3)∶n(H2O)=0.1 mol∶0.2 mol∶0.2 mol=1∶2∶2。所以晶体化学式为Na2CO3·2NaHCO3·2H2O。
。由此可知晶体中n(Na2CO3)∶n(NaHCO3)∶n(H2O)=0.1 mol∶0.2 mol∶0.2 mol=1∶2∶2。所以晶体化学式为Na2CO3·2NaHCO3·2H2O。

 小题狂做系列答案
小题狂做系列答案科目:高中化学 来源:不详 题型:单选题
| A.常温常压下,22.4 L的氧气含氧原子数为2NA |
| B.5.6g铁粉与足量Cl2反应,失去的电子数为0.2NA |
| C.常温下,23g NO2含有NA个氧原子 |
| D.足量铜与1L 18mol·L-1浓硫酸反应可以得到SO2的分子总数为9NA |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
A.常温下,0.1mol碳酸钠晶体中含有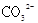 的个数为0.1NA 的个数为0.1NA |
| B.标准状况下,11.2L苯含有C-H键数目为3NA |
| C.常温常压下,54 g重水(D2O)含水分子数为3NA |
| D.将NA个Cl2分子通入足量的水中,所转移的电子总数为NA |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.ω=35a/(22.4Vρ) |
| B.c =a/(22.4V)mol/L |
| C.上述氨水中再加入等体积等浓度的稀盐酸后溶液恰好呈中性 |
| D.上述氨水中再加入V mL水后,所得溶液的质量分数小于0.5ω |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.1mol·L-1 | B.2.5 mol·L-1 | C.5 mol·L-1 | D.2 mol·L-1 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.100 mL | B.150 mL | C.450 mL | D.无法计算 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
A.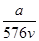 mol·L-1 mol·L-1 | B.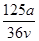 mol·L-1 mol·L-1 |
C.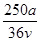 mol·L-1 mol·L-1 | D.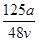 mol·L-1 mol·L-1 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.35g | B.30 g | C.20 g | D.15 g |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com