
分析 (1)原子晶体硬度大,熔沸点高;
(2)N含有7个质子,核外电子排布为K层2个、L层5个电子,原子与硅原子通过共价键结合成原子晶体氮化硅,氮显-3价,硅显+4价,正负化合价代数和为0写出化学式;
(3)根据质量守恒可知四氯化硅和氮气在氢气的气氛保护下,加强热发生反应,除生成氮化硅外还有氯化氢生成.
解答 解:(1)原子晶体硬度大,熔沸点高,根据氮化硅的物理性质:它的硬度大、熔点高、化学性质稳定,可知属于原子晶体,
故答案为:原子;
(2)N含有7个质子,核外电子排布为K层2个、L层5个电子,氮化硅中氮显-3价,硅显+4价,依据化合价代数和为0,可知氮化硅中氮原子数4个,硅原子数3个,化学式为:Si3N4;
故答案为:Si3N4;
(3)四氯化硅和氮气在氢气的气氛保护下,加强热发生反应,可得较高纯度的氮化硅以及氯化氢,方程式为3SiCl4+2N2+6H2$\frac{\underline{\;\;△\;\;}}{\;}$Si3N4+12HCl,故答案为:3SiCl4+2N2+6H2$\frac{\underline{\;\;△\;\;}}{\;}$Si3N4+12HCl.
点评 本题主要考查了氮化硅的性质与用途,根据原子的结构和物质的性质解答,方程式书写时,应注意依据原子个数守恒配平,题目难度不大.


科目:高中化学 来源: 题型:填空题
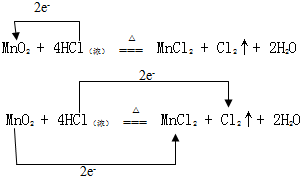 实验室通常用MnO2和浓盐酸共热制取Cl2,反应的化学方程式为MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O
实验室通常用MnO2和浓盐酸共热制取Cl2,反应的化学方程式为MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaHCO3与石灰水反应,当n(NaHCO3):n[Ca(OH)2]=3:1时,溶液中无HCO${\;}_{3}^{-}$ | |
| B. | CO2通入石灰水中,当n(CO2):n[Ca(OH)2]=1:1时,能得到澄清溶液 | |
| C. | AlCl3溶液与烧碱溶液反应,当n(OH-):n(Al3+)=5:1时,铝元素以AlO${\;}_{2}^{-}$形式存在 | |
| D. | Fe与稀硝酸反应,当n(Fe):n(HNO3)=1:1时,溶液中只有Fe3+存在 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | C+H2O$\frac{\underline{\;高温\;}}{\;}$ CO+H2 | B. | 2K+2H2O═2KOH+H2↑ | ||
| C. | 2F2+2H2O═4HF+O2 | D. | 2Na2O2+2H2O═4NaOH+O2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 向100mL 3mol/L的NaOH溶液中缓慢通入一定量的CO2,充分反应得溶液X.在上述溶液X中,逐滴缓慢滴加1mol/L的盐酸,所得气体(不考虑溶解于水)的体积与所加盐酸的体积关系如图所示,求:
向100mL 3mol/L的NaOH溶液中缓慢通入一定量的CO2,充分反应得溶液X.在上述溶液X中,逐滴缓慢滴加1mol/L的盐酸,所得气体(不考虑溶解于水)的体积与所加盐酸的体积关系如图所示,求:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
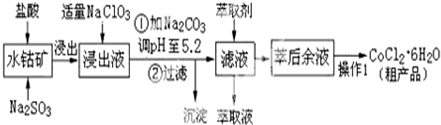
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Co(OH)2 | Al(OH)3 | Mn(OH)2 |
| 开始沉淀 | 2.7 | 7.6 | 7.6 | 4.0 | 7.7 |
| 完全沉淀 | 3.7 | 9.6 | 9.2 | 5.2 | 9.8 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 气体E呈红棕色,不能直接排放 | |
| B. | 溶液S中所含溶质、沉淀R都可用作药物 | |
| C. | 合金样品中Cu的质量分数为$\frac{a-b-c}{a}$×100% | |
| D. | 合金样品中Al的质量分数为$\frac{9c}{17a}$×100% |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com