
在含Na2CO3和NaHCO3各1 mol的混合溶液中加入0.5 mol下列物质,其中能使HC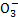 的数目减少,C
的数目减少,C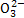 数目增加的是( )
数目增加的是( )
A.HCl B.Na2SO4 C.NaOH D.BaCl2
 每日10分钟口算心算速算天天练系列答案
每日10分钟口算心算速算天天练系列答案科目:高中化学 来源: 题型:
已知:反应CaCO3(s)===CaO(生石灰,s)+CO2(g)
ΔH(298.15 K)=178.3 kJ·mol-1
ΔS(298.15 K)=169.6 J·mol-1·K-1。通过计算判断此反应在室温下能否自发进行,并粗略计算此反应能自发进行的最低温度。
查看答案和解析>>
科目:高中化学 来源: 题型:
在一密闭容器中,用等物质的量的A和B发生如 下反应:A(g)+2B(g)
下反应:A(g)+2B(g)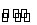
2C(g),反应达到平衡时,若混合气体中A和B的物质的量之和与C的物质的量相等,则此时A的转化率为( )
A.40% B.50% C.60% D.70%
查看答案和解析>>
科目:高中化学 来源: 题型:
除去乙酸乙酯中的乙酸杂质,下列方法可行的是( )
A.加乙醇、浓硫酸,加热
B.加NaOH溶液,充分振荡后,分液
C.直接分液
D.加饱和Na2CO3溶液,充分振荡后分液
查看答案和解析>>
科目:高中化学 来源: 题型:
Ⅰ.已知:
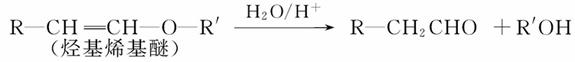
烃基烯基醚A的相对分子质量(Mr)为176,分子中碳氢原子数目比为3∶4。与A相关的反应如下:
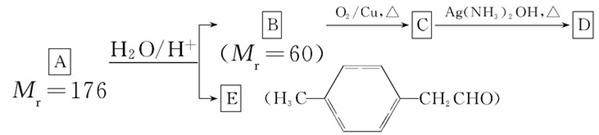
请回答下列问题:
(1)A的分子式为___________________________。
(2)B的名称是;A的结构简式为_____________________________。
(3)写出C→D反应的化学方程式:____________________________________。
(4)写出两种同时符合下列条件的E的同分异构体的结构简式:______________、______________。
① 属于芳香醛;
② 苯环上有两种不同环境的氢原子。
Ⅱ.由E转化为对甲基苯乙炔
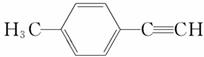 ( )的一条路线如下:
( )的一条路线如下:
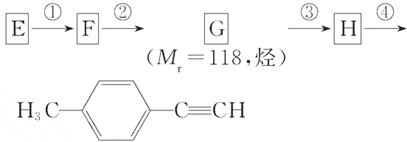
(5)写出G的结构简式:______________________________________。
(6)写出①~④步反应所加试剂、反应条件和 ①~③步反应类型:
| 序号 | 所加试剂及反应条件 | 反应类型 |
| ① | ||
| ② | ||
| ③ | ||
| ④ |
查看答案和解析>>
科目:高中化学 来源: 题型:
铁是应用最广泛的金属,铁的卤化物、氧化物以及高价铁的含氧酸盐均为重要化合物。
(1)要确定铁的某氯化物FeClx的化学式,可用离子交换和滴定的方法。实验中称取0.54 g的FeClx样品,溶解后先进行阳离子交换预处理,再通过含有饱和OH-的阴离子交换柱,使Cl-和OH-发生交换。交换完成后,流出溶液的OH-用0.40 mol·L-1的盐酸滴定,滴至终点时消耗盐酸25.0 mL。计算该样品中氯的物质的量,并求出FeClx中x值:________(列出计算过程)。
(2)现有一含有FeCl2和FeCl3的混合物样品,采用上述方法测得n(Fe)∶n(Cl)=1∶2.1,则该样品中FeCl3的物质的量分数为________。在实验室中,FeCl2可用铁粉和________反应制备,FeCl3可用铁粉和________反应制备。
(3)FeCl3与氢碘酸反应时可生成棕色物质,该反应的离子方程式为________________________。
(4)高铁酸钾(K2FeO4)是一种强氧化剂,可作为水处理剂和高容量电池材料。FeCl3与KClO在强碱性条件下反应可制取K2FeO4,其反应的离子方程式为________________________。与MnO2-Zn电池类似,K2FeO4-Zn也可以组成碱性电池,K2FeO4在电池中作为正极材料,其电极反应式为___________________,
该电池总反应的离子方程式为______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
合成氨反应N2(g)+3H2(g)
 2NH3(g)在某温度下达平衡时,各物质的浓度是[N2]=3 mol·L-1,[H2]=9 mol·L-1,[NH3]=4 mol·L-1,求该温度时的平衡常数和N2、H2的起始浓度。
2NH3(g)在某温度下达平衡时,各物质的浓度是[N2]=3 mol·L-1,[H2]=9 mol·L-1,[NH3]=4 mol·L-1,求该温度时的平衡常数和N2、H2的起始浓度。
查看答案和解析>>
科目:高中化学 来源: 题型:
将0.1 mol的镁和铝的混合物溶于100 mL 2 mol·L-1H2SO4溶液中,然后再滴加1 mol·L-1的NaOH溶液。请回答下列问题:
(1)若在滴加NaOH溶液的过程中,沉淀质量m随加入NaOH溶液的体积V的变化如图所示:
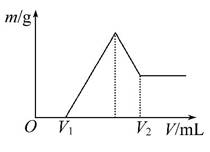
①有关反应的离子方程式为 ______________________________________。
②当V1=160 mL时,则金属粉末中n(Mg)=_________mol,V2=________mL。
(2)若在滴加NaOH溶液的过程中,欲使Mg2+、Al3+刚好沉淀完全,则滴入NaOH溶液的体积V(NaOH)=________mL。
查看答案和解析>>
科目:高中化学 来源: 题型:
下图所示为一个有机合成反应的流程图:

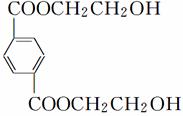
请根据图示回答下列问题:
(1)写出中间产物A、B、D的结构简式。
A______________________,B________________________________________________________________________,
D________________。
(2)在图中①至⑦的反应中属于取代反应的是________。(填序号)
(3)写出C的同分异构体X,要求符合以下两个条件:
ⅰ.苯环上有两个侧链;
ⅱ.1 mol X与足量NaHCO3溶液反应产生1 mol CO2气体。
写出符合上述两条件的X的所有结构简式____________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com