
【题目】某化学小组欲制取氨气设计了如下图所示装置(另有橡胶管若干可选用)。
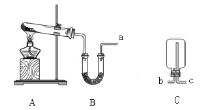
(1)A中制氨气的化学方程式是____________________________________。
(2)B中应装___________,作用是____________。
(3)收集氨气时,B装置的a口应连接C装置的___________(填“b”或“c”)口;证明氨气已集满的操作和现象是______________________________。
【答案】2NH4Cl+Ca(OH)2![]() CaCl2+2NH3↑+2H2O 碱石灰 干燥氨气 c 用湿润的红色石蕊试纸靠近出气(或“b”)口,试纸变蓝,说明氨气已集满
CaCl2+2NH3↑+2H2O 碱石灰 干燥氨气 c 用湿润的红色石蕊试纸靠近出气(或“b”)口,试纸变蓝,说明氨气已集满
【解析】
在实验室中用铵盐与碱共热制取氨气,氨气是碱性气体,可以用碱石灰等碱性干燥剂干燥,由于氨气的密度比空气小,因此要使用向下排空气方法收集,可根据氨气的水溶液显碱性,用湿润的红色石蕊试纸检验或验满。
(1)在实验室中用NH4Cl与Ca(OH)2混合加热制取氨气,反应的方程式为:2NH4Cl+Ca(OH)2![]() CaCl2+2NH3↑+2H2O;
CaCl2+2NH3↑+2H2O;
(2)制取得到的氨气中含有水蒸气,由于氨气水溶液显碱性,不能与碱性物质反应,所以可用装有碱性干燥剂碱石灰的U型管进行干燥处理,即B中应装固体干燥剂碱石灰,其作用是干燥氨气或吸收氨气中的水蒸气;
(3)氨气的密度比空气小,在收集氨气时,应该使用向下排空气的方法收集,即B装置的a口应连接C装置的c口;若要证明氨气已经收集满,可在收集氨气的集气瓶的出气口b处,用用湿润的红色石蕊试纸靠近出气(或“b”)口,若试纸变蓝,说明氨气已集满。


 一诺书业暑假作业快乐假期云南美术出版社系列答案
一诺书业暑假作业快乐假期云南美术出版社系列答案科目:高中化学 来源: 题型:
【题目】2008年9月,中国爆发三鹿毒奶粉事件,其原因是奶粉中含有三聚氰胺。三聚氰胺是一种重要的有机化工原料。它的结构简式如图,下列说法中正确的是

A. 该物质可用作食品添加剂
B. 三聚氰胺属于有机高分子化合物
C. 分子中所有原子都在同一平面上
D. 三聚氰胺含氮量很高,能冒充蛋白质通过检验
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物A的结构简式为![]() ,它可通过不同化学反应分别制得B、C、D和E四种物质。
,它可通过不同化学反应分别制得B、C、D和E四种物质。
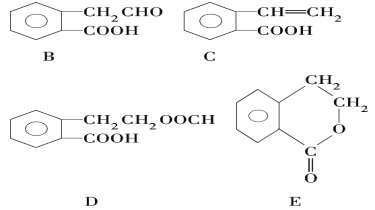
请回答下列问题:
(1)在A~E五种物质中,互为同分异构体的是____________ (填序号)。
(2)C能形成高聚物,该高聚物的结构简式为 _______________________。
(3)指出反应的类型:A→C:_________,E中含有的官能团的名称:_______
(4)写出由A生成B的化学方程式_______________________。
(5)已知HCHO分子中所有原子都在同一平面内,则在上述分子中所有的原子有可能都在同一平面的物质是__________________(填序号)。
查看答案和解析>>
科目:高中化学 来源: 题型:
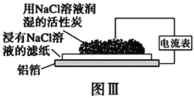
【题目】在日常生活中,我们经常看到铁制品生锈、铝制品表面出现白斑等众多的金属腐蚀现象。可以通过下列装置所示实验进行探究。下列说法正确的是
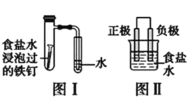
A.按图Ⅰ装置实验,加热具支试管可更快更清晰地得到实验证据—观察到液柱上升
B.图Ⅱ是图Ⅰ所示装置的原理示意图,图Ⅱ的正极材料是铁
C.铝制品表面白斑可用图Ⅲ装置进行探究,Cl-在铝箔表面区发生电极反应:2Cl- -2e-=Cl2↑
D.图Ⅲ装置的总反应为4Al+3O2+6H2O=4Al(OH)3,生成的Al(OH)3脱水形成白斑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】瑞典化学家舍勒在研究软锰矿(主要成分是MnO2)的过程中,将其与浓盐酸混合加热,产生了黄绿色气体。
(1)该反应的化学方程式为____________________。
(2)反应中氧化剂是_______(填化学式),锰元素的化合价________(填“升高”或“降低”)。若消耗了17.4 g MnO2,则生成标准状况下Cl2的体积是_______L,转移电子的物质的量是______mol。
(3)用此反应制得的氯气中常混有_______,要收集到干燥纯净的氯气,应使气体依次通过装有_______、_______的洗气瓶后再收集。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学在实验室中进行如下两组实验:①T1K时,将2mL0.02mol·L-1的酸性KMnO4溶液与2mL0.2mol·L-1草酸溶液混合,观察到溶液完全褪色所需要的时间是4s;②T2K 时,将2mL0.03 mol·L-1的酸性KMnO4溶液与2mL0.2 mol·L-1草酸溶液混合,观察到溶液完全褪色所需要的时间是5s。下列说法正确的是
A.实验①反应速率较快B.实验②反应速率较快
C.无法比较二者反应速率的快慢D.T2—定高于T1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组数据中,后者刚好是前者两倍的是
A.51 g氧化铝中氧原子数和67.2 L一氧化碳中氧原子数
B.1molCO2的摩尔质量和2 molCO2的摩尔质量
C.50 mL 2 mol·L-1氯化钠溶液中c(Cl-)和50 mL 2 mol·L-1氯化镁溶液中c(Cl-)
D.1molNa2O2固体中阳离子与阴离子比值和1molNa2O固体中阳离子与阴离子比值
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、W、R是原子序数依次增大的前四周期主族元素,X能形成多种单质,其中有两种单质硬度差异极大,Z可分别与Y、W、R形成几种常见的二元化合物,其中有两种是大气污染物,R原子最外电子层上有1个电子。
(1) R2Z2的电子式为___, Y、Z、W的简单离子半径由大到小的顺序为______(填离子符号)。
(2) X与Z可形成X2Z、X2Z3两种不常见的气体化合物,X2Z燃烧生成XZ2,写出X2Z与CuO反应的化学方程式_____,X2Z3与水反应生成二元弱酸(H2X2Z4),则X2Z3与NaOH溶液反应的离子方程式为_______。
(3)Y2H4是一种可燃性液体,16.0 gY2H4在氧气中完全燃烧生成一种单质与液态水时可放出312kJ的热量,写出Y2H4燃烧的热化学方程式 _______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com