
| V |
| Vm |
| m |
| M |
| 1000ρω |
| M |
| 0.224L |
| 22.4L/mol |
| 46g×0.01mol |
| 1mol |
| 46 |
| 62 |
| 0.92g |
| 23g/mol |
| 0.04mol×40g/mol |
| 21.06g |
| 1000×d×7.60% |
| 40 |


科目:高中化学 来源: 题型:
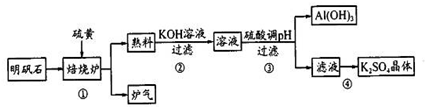
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
 如图所示,若电解5min时铜电极质量增加2.16g,试回答:
如图所示,若电解5min时铜电极质量增加2.16g,试回答:查看答案和解析>>
科目:高中化学 来源: 题型:

| 实验 次数 | 镁带质量 (g) | 硫酸体积 (mL) | C瓶中液体体积(mL) | 抽出气体的体积 (mL) | 氢气体积 (mL) | 计算1mol氢气体积(L) 两次实验的平均值(保留一位小数) |
| 1 | 0.120 | 10.0 | 119.3 | 8.0 | ||
| 2 | 0.112 | 10.0 | 115.7 | 6.2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com