
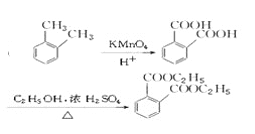
【题目】芳香化合物A是一种基本化工原料,可以从煤和石油中得到。OPA是一种重要的有机化工中间体。A,B,C,D,E,F和OPA的转化关系如下所示:
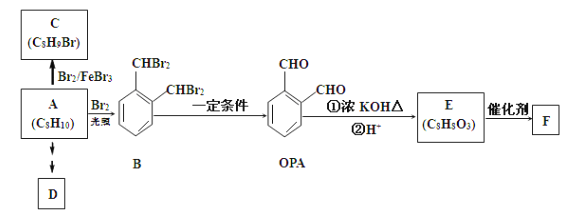
回答下列问题:
(1)A的化学名称是________。
(2)由A生成B的反应类型是________。在该反应的副产物中,与B互为同分异构体的化合物的结构简式为__________________。
(3)写出C所有可能的结构简式______________。
(4)D(邻苯二甲酸二乙酯)是一种增塑剂。请用A,不超过两个碳的有机物及合适的无机试剂为原料,经两步反应合成D。用化学方程式表示合成路线______________。
(5) OPA的化学名称是______________;OPA经中间体E可合成一种聚酯类高分子化合物F,由E合成F的反应类型为________,该反应的化学方程式为__________________。
提示: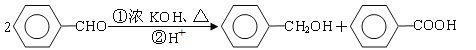
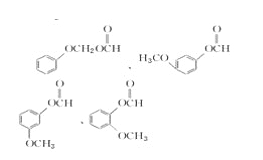
(6)芳香化合物G是E的同分异构体,G分子中含有醛基,酯基和醚基三种含氧官能团,写出G所有可能的结构简式________。
【答案】 邻二甲苯 取代反应 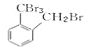
 邻苯二甲醛 缩聚反应
邻苯二甲醛 缩聚反应 
【解析】A和溴发生取代反应生成B,根据B的结构简式知,A是邻二甲苯,在溴化铁作催化剂条件下,邻二甲苯和溴发生取代反应生成C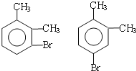 ,B发生一系列反应后生成邻苯二甲醛,结合已知条件知,邻苯二甲醛反应生成E,E的结构简式为
,B发生一系列反应后生成邻苯二甲醛,结合已知条件知,邻苯二甲醛反应生成E,E的结构简式为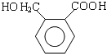 ,E发生缩聚反应生成F,F的结构简式为
,E发生缩聚反应生成F,F的结构简式为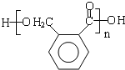 。
。
(1)A的结构简式为: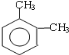 ,其名称是邻二甲苯,故答案为:邻二甲苯;
,其名称是邻二甲苯,故答案为:邻二甲苯;
(2)邻二甲苯和溴发生取代反应生成B,邻二甲苯的甲基上氢原子被溴原子取代生成溴代烃,在该反应的副产物中,与B互为同分异构体的化合物的结构简式为![]() ,故答案为:取代反应,
,故答案为:取代反应,![]() ;
;
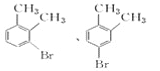
(3)在溴化铁作催化剂条件下,邻二甲苯和溴发生苯环上的取代反应,取代位置为甲基的邻、对位,所以C可能的结构简式为: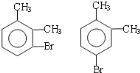 ,故答案为:
,故答案为: ;
;
(4)酸性条件下,邻二甲苯被高锰酸钾氧化生成邻苯二甲酸,在浓硫酸、加热条件下,邻苯二甲酸和乙醇发生酯化反应生成邻苯二甲酸二乙酯,故答案为:![]() ;
;
(5)OPA的化学名称是邻苯二甲醛,E发生缩聚反应生成F,该反应方程式为: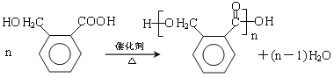 ,故答案为:邻苯二甲醛,缩聚反应,
,故答案为:邻苯二甲醛,缩聚反应, ;
;
(6)E的结构简式为 ,芳香化合物G是E的同分异构体,G分子中含有醛基、酯基和醚基三种含氧官能团,则G的结构简式可能为:
,芳香化合物G是E的同分异构体,G分子中含有醛基、酯基和醚基三种含氧官能团,则G的结构简式可能为: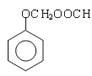 、
、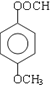 、
、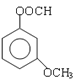 、
、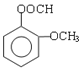 ,故答案为:
,故答案为: 、
、 、
、 。
。


科目:高中化学 来源: 题型:
【题目】国家游泳中心(水立方)的建筑采用了膜材料ETFE,该材料为四氟乙烯与乙烯的共聚物,四氟乙烯也可与六氟丙烯共聚成聚全氟乙丙烯,下列说法错误的是( )
A. ETFE分子中可能存在“﹣CH2﹣CH2﹣CF2﹣CF2﹣”的连接方式
B. 聚全氟乙丙烯分子的结构简式可能为![]()
C. 四氟乙烯分子中含有极性键和非极性键,六氟丙烯中所有原子不可能共平面
D. 合成ETFE及合成聚全氟乙丙烯的反应均为加聚反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用25%的稀H2SO4溶液与铁块反应制取氢气,下列措施能加快反应速率的是
A. 适当降低温度
B. 将铁块改为铁粉
C. 将所用硫酸改为98.3%浓硫酸
D. 滴加少量氢氧化钠溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA是阿伏加德罗常数的值,下列说法正确的是
A. 0.1mol FeCl3水解形成的Fe(OH)3胶体粒子数为0.1 NA
B. 常温下,78 g Na2O2中含有的阴离子数是2NA
C. 标准状况下,11.2 L甲烷和乙烯混合物中含氢原子数目为2NA
D. pH=1的H2SO4溶液中,含有H+的数目为0.1NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求填空:(填序号,下同)
(1)A NH4Cl B KCl C H2S D F2 E NaOH F H2O2 G Na2O2
①属于共价化合物的是;___________
②只含有离子键的是;___________
③既含有离子键又含有共价键的是_____________
(2)在下列变化中,①I2升华,②烧碱熔化,③NaCl溶于水, ④HCl溶于水,⑤O2溶于水,⑥Na2O2溶于水,未发生化学键破坏的是____;仅发生离子键破坏的是___;仅发生共价键破坏的是____;既发生离子键破坏,又发生共价键破坏的是____。
(3)现有A:![]() 、
、![]() 、
、![]() ;B:H2、D2、T2;C:石墨、金刚石;D:
;B:H2、D2、T2;C:石墨、金刚石;D:![]() 、
、![]() 、
、![]()
四组微粒或物质,回答下列问题:①互为同位素的是_______(填字母序号,下同)。 ②互为同素异形体的是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. 电解精炼铜时,粗铜与直流电源的负极相连
B. 镀层破损后,镀锡铁片中铁比镀锌铁片中铁耐腐蚀
C. 常温时,pH=2的盐酸与pH=12的氨水等体积混合,所得溶液pH=7
D. 合成氨反应N2(g) + 3H2(g)![]() 2NH3(g),当2v(N2)正 = v(NH3)逆时,反应达到平衡
2NH3(g),当2v(N2)正 = v(NH3)逆时,反应达到平衡
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,将0.05 mol Na2CO3固体溶于水配成100 mL溶液,向溶液中加入下列物质,有关结论正确的是( )
加入物质 | 结论 | |
A | 50 mL 1 mol·L-1H2SO4 | 反应结束后,c(Na+)=c(SO |
B | 0.05 mol CaO | 溶液中 |
C | 50 mL H2O | 由水电离出的c(H+)·c(OH-)不变 |
D | 0.1 mol NaHSO4固体 | 反应完全后,溶液pH减小,c(Na+)不变 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】含铁化合物在生活生产中应用广泛。如高铁酸盐(FeO42—)被科学家们公认为绿色消毒剂,在强碱性溶液中比较稳定;聚合硫酸铁则是一种高效絮凝剂。
(1)KClO饱和溶液与Fe(NO3)3饱和溶液反应可制备K2FeO4,两种溶液的混合方式为_______________,反应的离子方程为__________________________________________。
(2)高铁酸盐有极强的氧化性,能迅速有效地去除淤泥中的臭味物质,自身被还原成新生态的Fe(OH)3。已知Ksp[Fe(OH)3]=1.0×10-38。若要使溶液中Fe3+沉淀完全(使其浓度小于10-5 mol·L-1),需调节溶液的pH>________。
(3)聚合硫酸铁[Fex(OH)y(SO4)z]的组成可通过下列实验测定:
①称取一定质量的聚合硫酸铁配成100.00 mL溶液A;
②准确量取20.00 mL溶液A,加入盐酸酸化的BaCl2溶液至沉淀完全,过滤、洗涤、干燥至恒重,得到白色固体11.65 g;
③准确量取20.00 mL溶液A,加入足量铜粉,充分反应后过滤、洗涤,将滤液和洗液合并配成250.00 mL溶液B;
④准确量取25.00 mL溶液B,用0.1000 mol·L-1的酸性KMnO4溶液滴定至终点,消耗KMnO4溶液8.00 mL。
通过计算确定该聚合硫酸铁的化学式(写出计算过程) ______________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com