
| A. | S既作氧化剂又作还原剂 | B. | 消耗12gC时,反应转移5mol电子 | ||
| C. | 还原产物只有K2S | D. | KNO3只发生氧化反应 |
分析 该反应中S元素化合价由0价变为+6价、-2价,C元素化合价由0价变为+4价,N元素化合价由+5价变为0价,得电子化合价降低的反应物是氧化剂,失电子化合价升高的反应物是还原剂,再结合方程式分析解答.
解答 解:该反应中S元素化合价由0价变为+6价、-2价,C元素化合价由0价变为+4价,N元素化合价由+5价变为0价,
A.反应中S元素化合价由0价变为+6价、-2价,则S既作氧化剂又作还原剂,故A正确;
B.反应消耗12g C,即1molC时电子转移4mol,故B错误;
C.反应中部分S被还原为K2S,KNO3被还原为N2,则还原产物有K2S和 N2,故C错误;
D.反应中N元素化合价由+5价变为0价,则KNO3发生还原反应,故D错误;
故选A.
点评 本题考查氧化还原反应,侧重考查基本概念、基本计算,明确元素化合价变化即可解答,题目难度不大.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:选择题
| A. | 硫酸铜溶液 | B. | 稀硝酸 | C. | 盐酸 | D. | 硝酸银溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
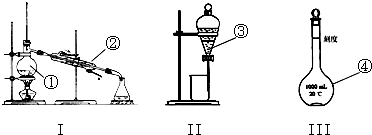
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH4 C2H4 C3H4 | B. | CH4 C2H6 C2H2 | C. | C2H2 C2H4 C3H4 | D. | C2H2C3H6 C4H8 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用HA溶液做导电实验,灯泡很暗 | |
| B. | HA和CaCO3发生反应放出CO2 | |
| C. | pH=2的HA溶液稀释至100倍,pH小于4 | |
| D. | pH=3的HA溶液中水电离出的c(H+)为10-11mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
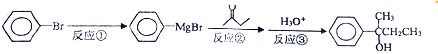
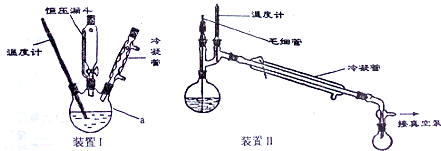
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com