
 文敬图书课时先锋系列答案
文敬图书课时先锋系列答案科目:高中化学 来源: 题型:
| 3 | 4 |
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
| 催化剂 |
| △ |
| 催化剂 |
| △ |
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
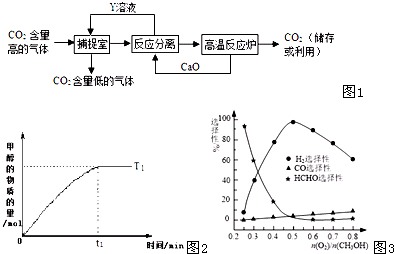
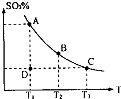 (1)在硫酸生产中,SO2催化氧化生成SO3是反应的关键,其反应的化学方程式为:2SO2(g)+O2(g)?2SO2(g),反应混合体系SO3的百分含量和温度的关系如图所示(曲线上任何一点都表示平衡状态),根据图示回答下列问题:
(1)在硫酸生产中,SO2催化氧化生成SO3是反应的关键,其反应的化学方程式为:2SO2(g)+O2(g)?2SO2(g),反应混合体系SO3的百分含量和温度的关系如图所示(曲线上任何一点都表示平衡状态),根据图示回答下列问题:| Kw |
查看答案和解析>>
科目:高中化学 来源:2013届河北省唐山一中高三第二次月考化学试卷(带解析) 题型:填空题
(14分)氨是重要的化工产品之一,研究合成氨反应具有重要意义。
(1) 已知断裂下列化学键需要吸收的能量分别为:
 ,
,
写出以N2和H2为原料合成NH3的热化学方程式________________________。
(2) 某小组研究了其他条件不变时,改变某一条件对上述反应的影响,实验结果如下图所示:
①t1时刻改变的条件为__________________。
②t2时刻,恒压充入氦气,t3时刻达到平衡。在图中画出t2时刻后的速率变化图像。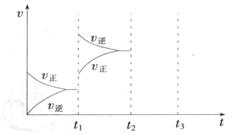
(3) 相同温度下,A、B、C三个密闭容器,A、B恒容,C带有可自由移动的活塞K,各向其中充入如图所示反应物,初始时控制活塞K使三者体积相等,一段时间后均达到平衡。
①达到平衡时,A、C两个容器中NH3的浓度分别为cl、c2,则c1______c2(填“>”、“<”或“=”)。
②达到平衡时,若A、B两容器中反应物的转化率分别为α(A),α(B),则α(A)+α(B)______1(填“ >”、“<”或“=”)。
③达到平衡时,若容器C的体积是起始时的3/4,则平衡时容器C中H2的体积分数为_______。
(4) 直接供氨式碱性燃料电池(DAFC),以KOH溶液为电解质溶液,其电池反应为 4NH3+3O2=2N2+6H2O,则负极的电极反应式为__________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com