
【题目】化学是以实验为基础的.利用已学知识对下列实验进行分析并填空:
Ⅰ.某研究性学习小组设计了一组实验来探究元素周期律.
甲同学根据元素非金属性与对应最高价含氧酸之间的关系,设计了如图1装置完成同主族元素C、Si非金属性强弱比较的实验研究;
乙同学设计了如图2装置实验来验证卤族元素性质的递变规律(夹持装置已略去).A、B、C三个胶头滴管分别是氯酸钾溶液、NaBr溶液、淀粉KI溶液.已知常温下浓盐酸与氯酸钾溶液能反应生成氯气.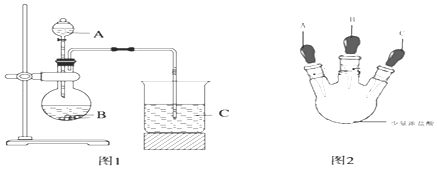
(1)甲同学设计实验所涉及的离子方程为:、 .
(2)乙同学具体操作如下:
①先挤压胶头滴管A,使少量溶液滴入烧瓶内;
②挤压胶头滴管B,使稍过量溶液滴入烧瓶内,充分反应.写出该操作中主要离子方程式为 .
③再挤压胶头滴管C,使少量溶液滴入烧瓶内,可观察到;
(3)根据甲乙同学的实验可得到的结论是:
(4)II.
实验 |
| ||
实验 |
|
|
|
实验 | 结论: | ||
反应 | |||
【答案】
(1)CaCO3+2H+=Ca2++CO2↑+H2O,SiO32﹣+CO2+H2O═H2SiO3↓+CO32﹣
(2)Cl2+2Br﹣=2Cl﹣+Br2,溶液由橙黄色变为蓝色
(3)同一主族元素,从上到下,元素的非金属性减弱
(4)探究温度对H2O2分解反应速率的影响,温度越高,化学反应速率越快,催化剂,2H2O2 ![]() 2H2O+O2↑
2H2O+O2↑
【解析】解:Ⅰ.(1)根据实验装置图可知,甲同学利用强酸制弱的原理比较酸性的强弱,利用元素的最高价氧化物的水化物酸性越强,则元素的非金属性超强,判断同主族元素非金属性强弱,能用该实验装置完成的应该是碳元素和硅元素的比较,所以该实验是用碳酸制硅酸,装置A和B是用强酸与碳酸钙反应生成二氧化碳,C中装硅酸钠溶液,将生成的二氧化碳通入硅酸钠溶液,有白色沉淀生成,反应的离子方程式为CaCO3+2H+=Ca2++CO2↑+H2O、SiO32﹣+CO2+H2O═H2SiO3↓+CO32﹣,
所以答案是:CaCO3+2H+=Ca2++CO2↑+H2O、SiO32﹣+CO2+H2O═H2SiO3↓+CO32﹣;
(2)②根据实验装置图及题中提供的试剂可知,乙同学利用单质的氧化性越强,元素的非金属性越强的原理比较氯、溴、碘的非金属性,具体操作为先用氯酸钾与浓盐酸反应生成氯气,形成氯水,再向溶液中滴加溴化钠溶液,生成溴,溶液出现橙黄色,反应的离子方程式为2Br﹣+Cl2Br2+2Cl﹣;
所以答案是:2Br﹣+Cl2Br2+2Cl﹣;
③再滴入淀粉碘化钾溶液,溴能氧化碘离子生成碘,溶液由橙黄色变为蓝色,
所以答案是:溶液由橙黄色变为蓝色;
(3)根据(1)可知,碳的非金属性强于硅,(2)可知,氯的非金属性强于溴,溴的非金属性强于碘,所以结论是同一主族元素,从上到下,元素的非金属性减弱,
所以答案是:同一主族元素,从上到下,元素的非金属性减弱;
Ⅱ.比较三个实验装置图可知,三个装置中的温度不同,根据对比实验的原理可其实验目的是探究温度对双氧水分解反应的速率的影响,温度越高,反应速率越快,双氧水越易分解.双氧水在氯化铁作催化剂的条件下发生分解生成氧气和水,反应的方程式为2H2O2 ![]() 2H2O+O2↑,
2H2O+O2↑,
所以答案是:
实验目的:探究温度对H2O2分解反应速率的影响 |
温度越高,化学反应速率越快 催化剂 |
2H2O2 |


科目:高中化学 来源: 题型:
【题目】在通常情况下能大量共存,并且可以用浓硫酸干燥的一组气体是( )
A.SO2、H2S、O2
B.CO、H2、Cl2
C.NO、H2、O2
D.HCl、CO、NH3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.现有三种短周期元素:①H ②Na ③Cl。
(1)氢原子结构示意图______; ②的单质在③的单质中燃烧,生成物是一种_______化合物(填“离子”或“共价”)。
(2)①与③形成的化合物的电子式是_______________,该化合物中含有___________共价键(填“极性”或“非极性”)。
Ⅱ.现有四种烃分子的球棍模型(如图)。
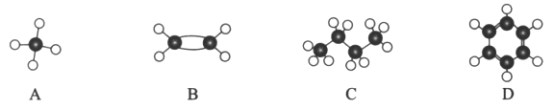
(1)与A互为同系物的是___________(填序号)。
(2)能使酸性高锰酸钾溶液褪色的物质是_____________(填序号)。
(3)C的同分异构体的结构简式是_____________________________。
(4)在光照条件下,A与氯气发生反应生成气态有机物的化学反应方程式是:________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.已知:2CO(g)+O2(g)=2CO2(g) ΔH=-566.0 kJ·mol-1;键能EO=O=499.0 kJ·mol-1则CO(g)+O2(g)CO2(g)+O(g)的ΔH=______kJ·mol-1。
Ⅱ.汽车尾气净化的主要反应原理为2NO(g)+2CO(g)2CO2(g)+N2(g)。将1.0 mol NO、0.8 mol CO充入2 L恒容密闭容器,分别在T1℃和T2℃下测得n(CO2)随时间(t)的变化曲线如下图所示。

(1)T2℃时,0~2s内的平均反应速率v(N2)= ________。
(2)该反应自发进行的条件(假设ΔH,ΔS不随温度变化而变化)___(高温自发,低温自发,任何温度均不自发,任何温度均自发)。
(3)为使该反应的反应速度增大,且平衡向正反方向移动的是________。
A.及时分离除CO2气体 B.适当升高温度
C.增大CO的浓度 D.选择高效催化剂
Ⅲ .工业可以采用下列反应合成甲醇:CO(g)+2H2(g) CH3OH(g),在一体积可变的密闭容器中(如图),将2 mol CO和3 mol H2放入容器中,移动活塞至体积为V L,用铆钉固定在A、B点,发生反应,测得在不同条件,不同时段内CO的转化率,得出下列数据。
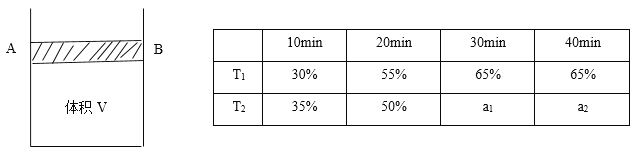
(1)根据上表数据,比较T1_______T2(选填“>、=、<”);T2温度下,第20 min时,反应达到平衡,该温度下的平衡常数为__________。
(2)T2温度下,第40 min时,拔出铆钉后,活塞没有发生移动,再向容器中通入6 mol的CO,此时V(正)________V(逆) (选填“>、=、<”),判断理由是:___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:A是石油裂解气的主要产物之一,其产量是衡量一个国家石油化工发展水平的标志。下列是有机物A~G之间的转化关系:
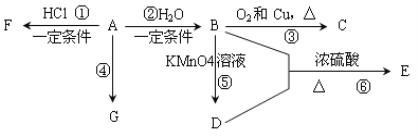
请回答下列问题:
(1)A、D中所含官能团的名称分别是_______________;C的结构简式是_____________;
(2)E是一种具有香味的液体,由B + D→E的反应方程式为:______________,反应类型是________。
(3)G是一种高分子化合物,其结构简式是____________________________________;
(4)俄罗斯足球世界杯激战正酣,在比赛中当运动员肌肉扭伤时,队医立即对其受伤部位喷射物质F进行应急处理。写出由A制F的化学反应方程式:___________。
(5)H是E的同分异构体,且H能与NaHCO3反应,则H的结构简式可能为(写出2种):_____________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列措施符合“绿色化学”思想的是
A. 直接排放含磷生活污水
B. 大量使用氟里昂作为冰箱制冷剂
C. 使用可降解塑料代替不可降解塑料
D. 使用化学性质稳定、不易分解的有机氯农药
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】治理SO2、CO、NOx污染是化学工作者研究的重要课题。
Ⅰ.硫酸厂大量排放含SO2的尾气会对环境造成严重危害。
(1)工业上可利用废碱液(主要成分为Na2CO3)处理硫酸厂尾气中的SO2,得到Na2SO3溶液,该反应的离子方程式为__________________________________。
Ⅱ.沥青混凝土可作为反应;2CO(g)+O2(g)![]() 2CO2(g)的催化剂。图甲表示在相同的恒容密闭容器、相同起始浓度、相同反应时间段下,使用同质量的不同沥青混凝土(α型、β型)催化时,CO的转化率与温度的关系。
2CO2(g)的催化剂。图甲表示在相同的恒容密闭容器、相同起始浓度、相同反应时间段下,使用同质量的不同沥青混凝土(α型、β型)催化时,CO的转化率与温度的关系。

(2)a、b、c、d 四点中,达到平衡状态的是__________________________________。
(3)已知c点时容器中O2浓度为0.02 mol/L,则50℃时,在α型沥青混凝土中CO转化反应的平衡常数K=____________(用含x的代数式表示)。
(4)下列关于图甲的说法正确的是_____________。
A.CO转化反应的平衡常数K(a)
B.在均未达到平衡状态时,同温下β型沥青混凝土中CO转化速率比α型要大
C.b点时CO与O2分子之间发生有效碰撞的几率在整个实验过程中最高
D.e点转化率出现突变的原因可能是温度升高后催化剂失去活性
Ⅲ.某含钴催化剂可以催化消除柴油车尾气中的碳烟(C)和NOx。不同温度下,将模拟尾气(成分如下表所示)以相同的流速通过该催化剂,测得所有产物(CO2、N2、N2O)与NO的相关数据结果如图乙所示。
模拟尾气 | 气体(10mol) | 碳烟 | ||
NO | O2 | He | ||
物质的量(mol) | 0.025 | 0.5 | 9.475 | n |
(5)375℃时,测得排出的气体中含0.45 molO2和0.0525 mol CO2,则Y的化学式为______________。

(6)实验过程中采用NO模拟NOx,而不采用NO2的原因是____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是( )
A.聚合物 ![]() 可由单体CH3CH=CH2和CH2=CH2加聚制得
可由单体CH3CH=CH2和CH2=CH2加聚制得
B.1 molCH3COOH与1mol CH3CH2OH在浓硫酸共热下生成的乙酸乙酯分子数为NA
C.乙醇、苯酚、乙酸都有羟基,但是羟基上的H活泼性不同,主要是基团之间相互影响造成的
D.等物质的量的乙炔和乙醛分别充分燃烧,所耗用氧气的量相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如表列出了①~⑧八种元素在周期表中的位置:
ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 | |
二 | ① | |||||||
三 | ② | ③ | ④ | ⑤ | ⑦ | |||
四 | ⑥ | ⑧ |
请按要求回答下列问题:
(1)元素③的原子结构示意图是_________________________,以上元素的最高价氧化物形成的水化物酸性最强的是_______________________(填分子式)。
(2)②、③、⑦三种元素的原子形成的简单离子半径由大到小的顺序排列为_____________(用离子符号表示);②、③、⑥三种元索的最高价氧化物对应的水化物碱性由弱到强的顺序是__________________(用化学式表示)。
(3)向元素②的单质与水反应后的溶液中加入元素④的单质,发生反应的化学方程式为________________。
(4)用离子方程式证明⑦⑧两元素非金属性的强弱__________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com