
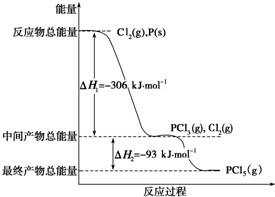
 已知红磷P(s)和Cl2(g)发生反应生成PCl3(g)和PCl5(g),反应过程和能量关系如图所示(图中的△H表示生成1mol产物的数据).
已知红磷P(s)和Cl2(g)发生反应生成PCl3(g)和PCl5(g),反应过程和能量关系如图所示(图中的△H表示生成1mol产物的数据).分析 根据反应物的总能量、中间产物的总能量以及最终产物的总能量,结合化学方程式以及热化学方程式的书写方法解答.
解答 解:①由图象可知,1molP与Cl2反应生成1molPCl3放出306KJ的能量,则反应的热化学方程式为P(s)+$\frac{3}{2}$Cl2(g)═PCl3(g)△H=-306kJ•mol-1,
故答案为:P(s)+$\frac{3}{2}$Cl2(g)═PCl3(g)△H=-306kJ•mol-1;
②由图象可知,PCl3和Cl2反应生成1molPCl5放出93KJ的能量,则反应的热化学方程式为PCl3(g)+Cl2(g)=PCl5(g)△H=-93 kJ•mol-1,
故答案为:PCl3(g)+Cl2(g)=PCl5(g)△H=-93 kJ•mol-1.
点评 本题考查热化学方程式的书写以及盖斯定律的应用,题目难度不大,注意正确理解并运用盖斯定律,注意热化学方程式的书写方法.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
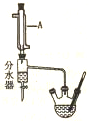 实验室用乙酸和正丁醇制备乙酸正丁酯.CH3COOH+CH3CH3CH2CH2OH$?_{△}^{浓硫酸}$CH3COOCH2CH2CH2CH3+H2O有关物质的相关数据如下表.
实验室用乙酸和正丁醇制备乙酸正丁酯.CH3COOH+CH3CH3CH2CH2OH$?_{△}^{浓硫酸}$CH3COOCH2CH2CH2CH3+H2O有关物质的相关数据如下表.| 化合物 | 相对分子质量 | 密度g.cm-3 | 沸点/ | 溶解度/100g水 |
| 正丁醇 | 74 | 0.80 | 118.0 | 9 |
| 冰醋酸 | 60 | 1.045 | 118.1 | 互溶 |
| 乙酸正丁酯 | 116 | 0.882 | 126.1 | 0.7 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ②④①③ | B. | ②①④③ | C. | ①②③④ | D. | ①②④③ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子最外层电子数:X>Y>Z | B. | 单质氧化性:X>Z>Y | ||
| C. | 离子半径:X2->Y+>Z- | D. | 原子序数:X>Y>Z |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题




查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 质量数相同的不同原子,其化学性质一定相同 | |
| B. | 质子数相同的原子,其核外电子排布也相同 | |
| C. | 金属性越强,其原子在反应中越易失去电子 | |
| D. | 非金属性越强,其阴离子越难失去电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com