
| A. | 0.1 mol•L-1 (NH4)2Fe(SO4)2溶液:c(SO42-)>c(NH4+)>c(Fe2+)>c(H+) | |
| B. | 0.1 mol•L-1 NaHCO3溶液:c(OH-)=c(H+)+2c(H2CO3)+c(HCO3-) | |
| C. | 0.1 mol•L-1Na2S溶液:2c(Na+)=c(S2-)+c(HS-)+c(H2S) | |
| D. | pH=12的NaOH溶液与等体积pH=2的醋酸混合后的溶液:c (CH3COO-)+c (OH-)=c (Na+)+c (H+) |
分析 A.铵根离子部分水解,导致铵根离子浓度减小,由于化学式(NH4)2Fe(SO4)2中含有1个亚铁离子,则亚铁离子的浓度最小;
B.根据碳酸氢钠溶液中的质子守恒判断;
C.根据硫化钠溶液中的物料守恒判断;
D.该溶液中满足电荷守恒,根据电荷守恒判断.
解答 解:A.0.1 mol•L-1 (NH4)2Fe(SO4)2溶液中,铵根离子部分水解,则c(SO42-)>c(NH4+),由于化学式(NH4)2Fe(SO4)2中含有1个Fe2+子,则c(NH4+)>c(Fe2+),溶液中离子浓度大小为:c(SO42-)>c(NH4+)>c(Fe2+)>c(H+),故A正确;
B.0.1 mol•L-1 NaHCO3溶液中,根据质子守恒可得:c(CO32-)+c(OH-)=c(H+)+c(H2CO3),故B错误;
C.0.1 mol•L-1Na2S溶液中,根据物料守恒可得:c(Na+)=2c(S2-)+2c(HS-)+2c(H2S),故C错误;
D.pH=12的NaOH溶液与等体积pH=2的醋酸混合后的溶液,根据电荷守恒可得:c (CH3COO-)+c (OH-)=c (Na+)+c (H+),故D正确;
故选AD.
点评 本题考查了离子浓度大小比较,题目难度中等,明确电荷守恒、物料守恒及质子守恒的含义为解答关键,注意掌握盐的水解原理及其应用方法,试题培养了学生的灵活应用能力.


科目:高中化学 来源: 题型:解答题
| 化合物 | MgO | Al2O3 | MgCl2 | AlCl3 |
| 类型 | 离子化合物 | 离子化合物 | 离子化合物 | 共价化合物 |
| 熔点/℃ | 2800 | 2050 | 714 | 191 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 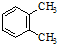 与 与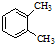 是同分异构体 是同分异构体 | |
| B. | 苯可以发生加成反应 | |
| C. | 可通过萃取的方法,从煤中提取苯 | |
| D. | 向2mL苯中加入1mL酸性高锰酸钾溶液,震荡后静置,可观察到液体分层,上层呈紫红色 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 某研究性学习小组对铝热反应实验展开研究.现行高中化学教材(必修加选修)中对“铝热反应”的现象有这样的描述:“反应放出大量的热,并发出耀眼的光芒”、“纸漏斗的下部被烧穿,有熔融物落入沙中”.查阅《化学手册》知,Al、Al2O3、Fe、Fe2O3熔点、沸点数据如下:
某研究性学习小组对铝热反应实验展开研究.现行高中化学教材(必修加选修)中对“铝热反应”的现象有这样的描述:“反应放出大量的热,并发出耀眼的光芒”、“纸漏斗的下部被烧穿,有熔融物落入沙中”.查阅《化学手册》知,Al、Al2O3、Fe、Fe2O3熔点、沸点数据如下:| 物质 | Al | Al2O3 | Fe | Fe2O3 |
| 熔点/℃ | 660 | 2054 | 1535 | 1462 |
| 沸点/℃ | 2467 | 2980 | 2750 | - |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 分散质粒子直径在1~100nm之间 | B. | 可用丁达尔效应区别这两种物质 | ||
| C. | 能用过滤的方法将它们分离 | D. | 都呈红褐色 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | +478.7kJ•mol-1 | B. | -764.5 kJ•mol-1 | ||
| C. | -478.7kJ•mol-1 | D. | +764.5kJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | SO2中混有少量SO3,通过足量浓硫酸,收集气体 | |
| B. | HNO3溶液中混有少量H2SO4,加入适量BaCl2溶液,再过滤 | |
| C. | 提取溴水中的溴,可用加入乙醇萃取的方法 | |
| D. | 检验溶液中是否含有Fe2+,向溶液中滴入氯水后,再滴加KSCN溶液 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com