
【题目】用NA表示阿伏加德罗常数的值,下列有关说法不正确的是
A. 由1mol CH3OCOONa和少量CH3COOH形成的中性溶液中,CH3COO-数目是NA
B. 1.68gFe与足量高温水蒸气反应,转移电子的数目为0.09NA
C. 氢原子数为0.4NA的CH3OH 分子中含有的电子数为1.8NA
D. 常温下,2L 0.1molL-1FeCl3溶液与1L0.2molL-1FeCl3溶液所含Fe3+数目不同
【答案】B
【解析】A. 由1mol CH3OCOONa和少量CH3COOH形成的中性溶液中,电荷守恒:c(CH3COO-)+ c(OH-) =c(H+)+ c(Na+),溶液呈中性,c(OH-) =c(H+),所以c(CH3COO-)=c(Na+),n(CH3COO-)=n(Na+),故A正确;B. 3Fe+4H2O(g)![]() Fe3O4+4H2,1.68g即0.03molFe与足量高温水蒸气反应,转移电子的数目为0.08NA,故B不正确;C. CH3OH 分子中含有4个氢原子,18个电子,所以氢原子数为0.4NA的CH3OH 分子中含有的电子数为1.8NA,故C正确;D. 稀释有利于盐类水解,常温下,2L 0.1molL-1FeCl3溶液与1L0.2molL-1FeCl3溶液,Fe3+的水解程度前者大于后者,所含Fe3+数目前者小于后者,故D正确。故选B。
Fe3O4+4H2,1.68g即0.03molFe与足量高温水蒸气反应,转移电子的数目为0.08NA,故B不正确;C. CH3OH 分子中含有4个氢原子,18个电子,所以氢原子数为0.4NA的CH3OH 分子中含有的电子数为1.8NA,故C正确;D. 稀释有利于盐类水解,常温下,2L 0.1molL-1FeCl3溶液与1L0.2molL-1FeCl3溶液,Fe3+的水解程度前者大于后者,所含Fe3+数目前者小于后者,故D正确。故选B。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】海水开发利用的部分过程如图所示。下列说法错误的是

A. 向苦卤中通入Cl2是为了提取溴
B. 粗盐可采用除杂和重结晶等过程提纯
C. 工业生产中常选用NaOH作为沉淀剂
D. 富集溴一般先用空气和水蒸气吹出单质溴,再用SO2将其还原吸收
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知蓄电池在充电时作电解池,放电时作原电池.铅蓄电池上有两个接线柱,一个接线柱旁标有“+”,另一个接线柱旁标有“﹣”.关于标有“+”的接线柱,下列说法中正确的是( )
A.充电时作阳极,放电时作正极
B.充电时作阳极,放电时作负极
C.充电时作阴极,放电时作负极
D.充电时作阴极,放电时放正极
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.原子晶体中只存在非极性共价键
B.稀有气体形成的晶体属于分子晶体
C.干冰升华时,分子内共价键会发生断裂
D.金属元素和非金属元素形成的化合物一定是离子化合物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】阿伏加德罗常数的值为NA,下列说法正确的是( )
A.在常温常压下,11.2LN2含有的分子数为0.5NA
B.1mol/L的NaOH溶液中含有的钠离子数目为NA
C.44gCO2与28gCO所含有的分子数均为NA
D.标准状况下,11.2L臭氧含有的氧原子数为NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列除杂操作可行的是( )
A.通过浓硫酸除去SO2中的H2OB.通过灼热的CuO除去H2中的CO
C.通过灼热的镁粉除去N2中的O2D.通过碱石灰除去O2中的NH3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现欲用纯净的CaCO3与稀盐酸反应制取CO2,生成CO2的体积与时间的关系如下图所示。下列叙述正确的是
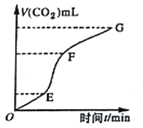
A. OE段化学反应速率最快
B. FG段收集的二氧化碳最多
C. 由图像无法推断出该反应为放热反应
D. 向溶液中加入氯化钠溶液,可以降低该反应的化学反应速率
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】苹果酸广泛存在于苹果等水果的果肉中是一种常用的食品添加剂。经测定,草果酸的相对分子质量为134,所含各元素的质量分数为w(C)=35.82%,w(H)=4.48%、w(O)=59.70%。其中存在5种不同化学环境的H原子。以乙烯为原料人工合成草果酸的线路如图所示:
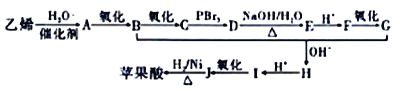
已知:①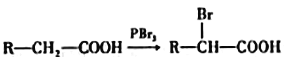
②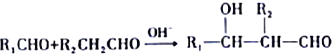
请回答下列问题:
(1)苹果酸的分子式为_______,B物质的名称为_______。F中含有的官能团名称是_______。
(2)G+B→H的反应类型是____________。I 的结构简式为___________________。
(3)D→E反应的化学方程式为________________________________。
(4)1mol苹果酸能与________molNaHCO3完全反应,能与足量的Na反应生成_______LH2(标况下)。
(5)与苹果酸含有相同种类和数量的官能团的同分异构体的结构简式为_________;其所有同分异构体在下列一种表征仪器中显示的信号(或数据)完全相同,该仪器是__________(填序号)。
a. 元素分析仪 b.红外光谱仪 c. 质谱仪 d.核磁共振仪
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】基于CaSO4为载氧体的天然气燃烧是一种新型绿色的燃烧方式,CaSO4作为氧和热量的有效载体,能够高效低能耗地实现CO2的分离和捕获其原理如下图所示:
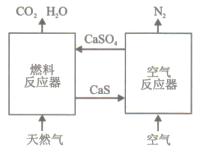
(1)已知在燃料反应器中发生如下反应:
i.4CaSO4(s)+CH4(g)=4CaO(s)+CO2(g)+4SO2(g)+2H2O(g) ΔH1=akJ/mol
ii.CaSO4(s)+CH4(g)=CaS(s)+CO2(g)+2H2O(g) ΔH2=bkJ/mol
ⅲ. CaS(s)+3CaSO4(s)= 4CaO(s)+4SO2(g) ΔH3=ckJ/mol
①燃料反应器中主反应为_________(填“i”“ii”或“ⅲ”)。
②反应i和ii的平衡常数Kp与温度的关系如图1,则a_______0(填“ >”“ =“或“<” );720℃时反应ⅲ的平衡常数Kp=________。
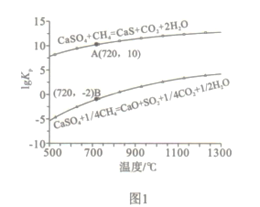
③下列措施可提高反应ii中甲烷平衡转化率的是_______。
A.增加CaSO4固体的投入量 B.将水蒸气冷凝
C.降温 D.增大甲烷流量
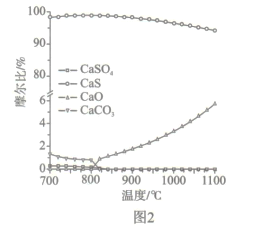
(2)如图2所示,该燃料反应器最佳温度范围为850℃ -900℃之间,从化学反应原理的角度说明原因:_______。
(3)空气反应器中发生的反应为
CaS(s) +2O2(g)=CaSO4(s) ΔH4=dkJ/mol
①根据热化学原理推测该反应为__________反应。
②在天然气燃烧过程中,可循环利用的物质为________。
(4)该原理总反应的热化学方程式为____________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com