
(12分)在体积不变的2L密闭容器中,进行如下化学反应:CO2(g)+H2(g) 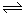 CO(g)+H2O(g),其化学平衡常数K和温度t的关系如表:
CO(g)+H2O(g),其化学平衡常数K和温度t的关系如表:
t℃ | 500 | 600 | 800 | 900 | 1000 |
K | 0.5 | 0.6 | 1.0 | 1.3 | 1.5 |
回答下列问题:
(1)该反应的化学平衡常数表达式为K=________。
(2)该反应正反应为_____反应(选填“吸热”“放热”)。
(3)某温度下,各物质的平衡浓度符合下式:
3c(CO2)·c(H2)=5c(CO)·c(H2O),试判断此时的温度为________。
(4)若800 ℃时,向容器中充入2 mol CO2、2 mol H2,反应进行到5min内,容器内CO的体积分数为20%,则用CO2表示的平均反应速率为 ,达到平衡后,CO2的转化率为 。
(5)800 ℃时,容器中的反应已达到平衡。在其他条件不变的情况下,扩大容器的体积。平衡________移动(填“向正反应方向”“向逆反应方向”或“不”)。
(1) (2)吸热 (3)600 ℃
(2)吸热 (3)600 ℃
(4)0.08 mol·(L·min)—1;50% (5)不
【解析】
试题分析:(1)根据平衡常数的定义,可知该反应的平衡常数K= ;
;
(2)温度升高,平衡常数增大,说明温度升高,平衡正向移动,所以该反应是吸热反应;
(3)平衡时,根据3c(CO2)·c(H2)=5c(CO)·c(H2O),可知K= =3/5=0.6,
=3/5=0.6,
所以该温度是600 ℃;
(4)因为该反应是气体物质的量不变的可逆反应,则平衡时气体的总物质的量是2+2=4mol,所以CO的物质的量是4mol×20%=0.8mol,则消耗二氧化碳的物质的量也是0.8mol,所以二氧化碳的反应速率是0.8mol/2L/5min=0.08 mol·(L·min)-1;800 ℃时,该反应的平衡常数是1,设平衡时,二氧化碳的物质的量减少xmol,则
CO2(g)+H2(g) 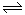 CO(g)+H2O(g)
CO(g)+H2O(g)
开始(mol) 2 2
转化(mol) x x x x
平衡(mol) 2-x 2-x x x
根据题意,则(x×x)/[(2-x)×(2-x)] =1,解得x=1,所以平衡时二氧化碳的转化率是1mol/2mol×100%=50%;
(5)800 ℃时,容器中的反应已达到平衡。在其他条件不变的情况下,扩大容器的体积,压强减小,而压强的改变对该反应无影响,因为该反应是气体物质的量不变的可能反应,所以平衡不移动。
考点:考查平衡常数的表达与应用,反应速率的计算,平衡移动的判断


科目:高中化学 来源:2014-2015学年四川省高一12月月考化学试卷(解析版) 题型:选择题
在Na2SO4和Al2(SO4)3的混合溶液中,测得Al3+浓度为0.1 mol·L-1,SO42-浓度为0.3 mol·L-1,则混合溶液中Na+的浓度为
A.0.3 mol·L-1 B.0.15 mol·L-1
C.0.6 mol·L-1 D.0.45 mol·L-1
查看答案和解析>>
科目:高中化学 来源:2014-2015学年山东省枣庄市高三1月月考理综化学试卷(解析版) 题型:选择题
下列说法正确的是:
A.新制氯水中加入固体NaOH, 则:c(Na+)=c(Cl-)+c(ClO-)+c(OH-)
B.25℃时,稀释0.5 mol·L-1的NH4Cl溶液,水解平衡右移,溶液的PH减小
C.常温下,pH=11的碱MOH溶液与pH=3的盐酸等体积混合后,溶液可能呈中性或酸性
D.测定相同条件下Na2CO3溶液和Na2SO4溶液的pH,判断碳与硫的非金属性强弱
查看答案和解析>>
科目:高中化学 来源:2014-2015学年山东省高三上学期12月月考化学试卷(解析版) 题型:选择题
下列叙述正确的是
A.酸性氧化物和碱性氧化物都是电解质
B.将NaOH溶液逐滴加入FeCl3溶液可制备Fe(OH)3胶体
C.电化学腐蚀是造成金属腐蚀的主要原因
D.离子键一定只存在于离子化合物中,共价键一定只存在于共价化合物中
查看答案和解析>>
科目:高中化学 来源:2014-2015学年山东省高三上学期12月月考化学试卷(解析版) 题型:选择题
在下列给定条件的溶液中,一定能大量共存的离子组是
A.加水稀释C(OH?)/C(H+)增大的溶液:K+、Na+、SO42-、[Al(OH)4]-
B.常温下Kw/c(H+)=0.1 mol/L的溶液:K+、Na+、SiO32-、NO3-
C.铁片加入产生气泡的溶液:Na+、NH4+、I-、NO3-
D.NaHCO3溶液:K+、Na+、SO42-、Al3+
查看答案和解析>>
科目:高中化学 来源:2014-2015学年内蒙古巴彦淖尔市高三上学期期中考试化学试卷(解析版) 题型:选择题
合成氨反应:N2(g)+3H2(g) 2NH3(g) ΔH=-92.4 kJ·mol-1,在反应过程中,正反应速率的变化如图
2NH3(g) ΔH=-92.4 kJ·mol-1,在反应过程中,正反应速率的变化如图

下列说法正确的是
A.t1时升高了温度
B.t2时使用了催化剂
C.t3时增大了压强
D.t4时降低了温度
查看答案和解析>>
科目:高中化学 来源:2014-2015学年内蒙古巴彦淖尔市高三上学期期中考试化学试卷(解析版) 题型:选择题
一定温度下,1molX和n mol Y在容积为2L的密闭容器中发生如下反应:
X(g)+Y(g) Z(g)+M(s),5min后达到平衡,此时生成a mol Z。下列说法正确的是
Z(g)+M(s),5min后达到平衡,此时生成a mol Z。下列说法正确的是
A.向平衡后的体系中加入1mol M,平衡向逆反应方向移动
B.用X表示此反应的反应速率是(0.1—0.1a)mol·(L·min)—1
C.向上述平衡体系中再充入1molX,v(正)增大,v(逆)减小,平衡正向移动
D.当混合气体的质量不再发生变化时,说明反应达到平衡状态
查看答案和解析>>
科目:高中化学 来源: 题型:



| 滴定次数 | 第一次 | 第二次 | 第三次 |
| 滴定前读数(mL) | 0.10 | 0.36 | 1.10 |
| 滴定滴定后读数(mL) | 20.12 | 20.34 | 22.12 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 如图是实验室制取气体的装置,其中发生装置相同,干燥和集气装置有两套,分别用图1和图2表示.下列选项中正确的是( )
如图是实验室制取气体的装置,其中发生装置相同,干燥和集气装置有两套,分别用图1和图2表示.下列选项中正确的是( )| 选项 | 发生装置中的药品 | 干燥和集气装置 |
| A | 亚硫酸钠和稀盐酸 | 图2 |
| B | 大理石和稀盐酸 | 图1 |
| C | 铜和稀硝酸 | 图2 |
| D | 氧化钙和浓氨水 | 图1 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com