
| A. | 锌是负极,发生还原反应 | |
| B. | O2在正极发生氧化反应 | |
| C. | 工作一段时间后,电解质溶液的碱性会减弱 | |
| D. | 该电池能将化学能全部转化为电能 |
分析 由电池放电时总反应:2Zn+O2+4OH-+2H2O═2Zn(OH)42-,电解液是KOH溶液,则负极为锌失电子发生氧化反应,氧气得电子反应还原反应,据此分析解答.
解答 解:A、根据该电池放电时的总反应可知:放电时,Zn失电子发生氧化反应,所以Zn作电池的负极,故A错误;
B、正极上是氧气得电子发生还原反应,故B错误;
C、由电池放电时总反应:2Zn+O2+4OH-+2H2O═2Zn(OH)42-,则工作一段时间后,消耗氢氧根离子,所以电解质溶液的碱性会减弱,故C正确;
D、任何一个电池都不可能将化学能全部转化为电能,故D错误.
故选C.
点评 本题考查了锌-空气电池,主要是对原电池原理的考查,题目的难点是总反应方程式的分析,平时学习时注意有关规律的归纳整理.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:选择题
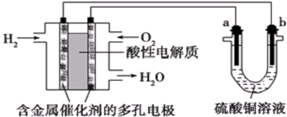
| A. | 燃料电池工作时,正极反应为O2+2H2O+4e-=4OH- | |
| B. | a极是铁,b极是铜时,铁片表面会镀上一层红色的铜 | |
| C. | a、b两极若是石墨,在相同条件下a极产生的气体与电池中消耗的H2体积相等 | |
| D. | a极是粗铜,b极是纯铜时,a极逐渐溶解,b极上有铜析出 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 纯碱溶液和烧碱溶液均呈碱性,说明二者均属于碱 | |
| B. | Cl2、SO2均能使品红溶液褪色,说明二者均有氧化性 | |
| C. | 某酸与Na2CO3反应生成CO2,说明该酸一定是强酸 | |
| D. | 某溶液中滴加KSCN溶液后,溶液不变色,滴加氯水后溶液显红色,该溶液中一定含Fe2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
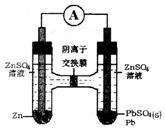
| A. | SO42-从右向左迁移 | |
| B. | 电池的正极反应为:Pb2++2e-═Pb | |
| C. | 左边ZnSO4浓度增大,右边ZnSO4浓度不变 | |
| D. | 若有6.5g锌溶解,有0.1 molSO42-通过离子交换膜 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 若X、Y的物质的量之比为1:4,且N是黄绿色气体,则该反应的离子方程式为MnO2+4H++2Cl-$\frac{\underline{\;\;△\;\;}}{\;}$Mn2++Cl2↑+2H2O | |
| B. | 若M、N为气体,且都能使澄清石灰水变浑浊,则将此混合气体通入溴水中,橙色褪色,橙色褪色过程的离子方程式为SO2+Br2+2H2O=4H++SO42-+2Br- | |
| C. | 若X是铁,Y是稀硝酸(过量),则X与Y反应的离子方程式为Fe+4H++NO3-=Fe3++NO↑+2H2O | |
| D. | 当N为氯碱工业的主要原料,M是造成温室效应的主要气体,则上述反应的离子方程式一定为CO32-+2H+=CO2↑+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 13g乙炔中含有共用电子对的数目为1.5NA | |
| B. | 含有2NA个氧原子的氧气和臭氧的混合气体的质量为32g | |
| C. | 1 mol•L-1碳酸钠溶液中含有的碳酸根离子的数目小于NA | |
| D. | 标准状况下,将22.4LCl2通入水中发生反应,转移的电子数为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
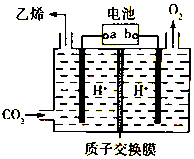
| A. | b为铅蓄电池的正极 | |
| B. | 电解过程中,阳极区溶液中c(H+)逐渐减小 | |
| C. | 阴极反应式:2CO2+12H++12e-═C2H4+4H2O | |
| D. | 每生成1mol乙烯,理论上铅蓄电池中消耗12mol硫酸 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com