
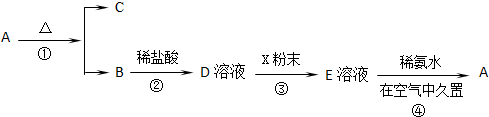
分析 固体化合物A,按下图所示发生系列变化,已知E溶液中加入氨水后产生的白色沉淀很快变为灰绿色,最后变为红褐色,B到D时加入的盐酸,推断E为FeCl2,A为Fe(OH)3,A加热分解生成B为Fe2O3,C为H2O,依据流程分析判断D为FeCl3,X为Fe,E为FeCl2溶液,依据分析推断出的物质分析回答.
解答 解:已知E溶液中加入氨水后产生的白色沉淀很快变为灰绿色,最后变为红褐色说明A为氢氧化铁Fe(OH)3,A加热分解生成B为Fe2O3,C为H2O,依据流程分析判断D为FeCl3,X为Fe,E为FeCl2溶液,
反应①是氢氧化铁分解生成氧化铁和水的反应,反应为2Fe(OH)3$\frac{\underline{\;\;△\;\;}}{\;}$Fe2O3+3H2O;
反应②是盐酸和氧化铁发生的复分解反应,反应为Fe2O3+6HCl=2FeCl3+3H2O;
反应③是氯化铁和铁发生的氧化还原反应,反应为Fe+2FeCl3=3FeCl2,离子方程式为2Fe3++Fe═3Fe2+;
反应④是氢氧化亚铁和氧气水 发生反应生成氢氧化铁的也还原反应,反应化学方程式为4Fe(OH)2+O2+2H2O=4Fe(OH)3.
(1)依据推断可知A为Fe(OH)3,B为Fe2O3,俗名为铁红,
故答案为:Fe(OH)3;铁红;
(2)反应③是氯化铁和铁发生的氧化还原反应,反应为Fe+2FeCl3=3FeCl2,离子方程式为2Fe3++Fe═3Fe2+;
反应④是氢氧化亚铁和氧气水 发生反应生成氢氧化铁的也还原反应,反应化学方程式为4Fe(OH)2+O2+2H2O=4Fe(OH)3.
故答案为:2Fe3++Fe═3Fe2+;4Fe(OH)2+O2+2H2O=4Fe(OH)3;
(3)若E变质,亚铁离子会被氧化成铁离子,可使用硫氰化钾溶液检验,方法为:取少量氯化亚铁样品盛于试管,加蒸馏水使之溶解,滴入几滴KSCN溶液,若溶液呈血红色,说明样品有变质,若溶液不呈红色,则未变质;如果变质,硫酸亚铁溶液中存在硫酸铁,为了不引进新的杂质,可以向硫酸亚铁溶液中加入少量的铁粉,将铁离子还原成亚铁离子,
故答案为:取少量氯化亚铁样品盛于试管,加蒸馏水使之溶解,滴入几滴KSCN溶液,若溶液呈血红色,说明样品有变质,若溶液不呈红色,则未变质;配制硫酸亚铁溶液时,在溶液中加入少量还原铁粉.
点评 本题考查了铁及其化合物性质的分析判断,物质转化关系和特征反应的分析应用是解题关键,题目难度中等,注意把握实验方案的设计和物质的检验.


 优翼小帮手同步口算系列答案
优翼小帮手同步口算系列答案科目:高中化学 来源: 题型:选择题
| A. | 在墙壁刚粉刷过石灰浆的室内生一炭火盆,墙壁会“冒汗” | |
| B. | 以二氧化硅为主要原料制造光导纤维 | |
| C. | 碳炉边放盆水,可防止煤气中毒 | |
| D. | 用干冰进行人工降雨 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将氯气、铁按n(Cl2):n(Fe)=5:4混合点燃:5Cl2+4Fe$\frac{\underline{\;点燃\;}}{\;}$2FeCl3+2FeCl2 | |
| B. | 将0.5molN2和1.5molH2于密闭容器中充分反应生成NH3(g),放热19.3kJ,其热化学方程式为N2(g)+3H2(g)═2NH3(g)△H=-38.6kJ•mol-1 | |
| C. | 将大理石粉末置于FeCl3溶液中有气泡产生:2Fe3++3H2O+3CaCO3═2Fe(OH)3↓+3CO2↑+3Ca2+ | |
| D. | 将浓度均为0.1mol•L-1的NaOH、NH4HCO3等体积混合:NH4++OH-═NH3•H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 苯和液溴用溴化铁作催化剂生成溴苯 | |
| B. | 向苯酚浓溶液中滴入少量浓溴水可观察到白色三溴苯酚沉淀 | |
| C. | 银氨溶液配制后加入稀硝酸使溶液呈酸性,再滴入乙醛溶液共热,有银镜生成 | |
| D. | 加氢氧化钠钠溶液,充分振荡,分液可除去乙酸乙酯中的乙酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,2.24 L CCl4中含氯原子数目为0.4NA | |
| B. | 1 mol羟基(-OH)中含电子的数目为10NA | |
| C. | 1mol苯乙烯( )中含碳碳双键数为4NA )中含碳碳双键数为4NA | |
| D. | 2.8g乙烯和环丙烷的混合气体中含原子总数为0.6NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com