
【题目】氮的固定一直是科学家研究的重要课题,合成氨则是人工固氮比较成熟的技术,其原理为N2(g)+3H2(g)![]() 2NH3(g)
2NH3(g)
在不同温度、压强和相同催化剂条件下,初始时N2、H2分别为0.1mol、0.3mol时,平衡后混合物中氨的体积分数(φ)如图所示。
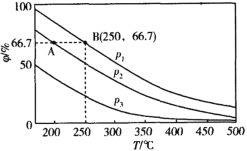
①其中,p1、p2和p3由大到小的顺序是___,其原因是___。
②若分别用vA(N2)和vB(N2)表示从反应开始至达平衡状态A、B时的化学反应速率,则vA(N2)___vB(N2)(填“>”“<”或“=”)。
③若在250℃、p1为105Pa条件下,反应达到平衡时容器的体积为1L,则该条件下B点N2的分压p(N2)为___Pa(分压=总压×物质的量分数,保留一位小数)。
【答案】p1>p2>p3 温度相同时,增大压强化学平衡向正反应方向移动,故平衡混合物中氨的体积分数越大压强越大 < 8.3×103
【解析】
①由方程式N2(g)+3H2(g)![]() 2NH3(g)可知,增大压强,平衡正向移动,氨的体积分数越大;
2NH3(g)可知,增大压强,平衡正向移动,氨的体积分数越大;
②温度越大,压强越大,反应速率越大;
③列出三段式,先求出氨的物质的量分数,再代入计算:p(N2)=总压×物质的量分数=105Pa×![]() 。
。
①由N2(g)+3H2(g)![]() 2NH3(g)可知,增大压强,平衡正向移动,由图象可知在相同温度下,平衡后混合物中氨的体积分数(φ)为P1>P2>P3,因此压强关系是P1>P2>P3,故答案为:P1>P2>P3;温度相同时,加压平衡正向移动,故压强越大平衡混合物中氨的体积分数越大;
2NH3(g)可知,增大压强,平衡正向移动,由图象可知在相同温度下,平衡后混合物中氨的体积分数(φ)为P1>P2>P3,因此压强关系是P1>P2>P3,故答案为:P1>P2>P3;温度相同时,加压平衡正向移动,故压强越大平衡混合物中氨的体积分数越大;
②温度越大,压强越大,反应速率越大,p1>p2,由图可知,B对应的温度、压强大,则反应速率大,故答案为:<;
③列出反的三段式:

![]() =0.667,x=0.08
=0.667,x=0.08
p(N2)=总压×物质的量分数=105Pa×![]() =8.3×103;
=8.3×103;
故答案为:8.3×103。


科目:高中化学 来源: 题型:
【题目】下列化学用语书写正确的是( )
A.金属发生电化学腐蚀的正极反应式:M-ne-=Mn+
B.家用小苏打溶于水后的电离:NaHCO3=Na++H++CO![]()
C.氯化铁溶液制备氢氧化铁胶体:Fe3++3H2O=Fe(OH)3↓+H+
D.用碳酸钠溶液处理锅炉水垢中的硫酸钙:CaSO4(s)+CO![]() (aq)CaCO3(s)+SO
(aq)CaCO3(s)+SO![]() (aq)
(aq)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氢能被视为最具发展潜力的清洁能源,开发新型储氢材料是氢能利用的重要研究方向。请回答下列问题:
Ⅰ.化合物A(H3BNH3)是一种潜在的储氢材料,可由六元环状物质(HB=NH)3通过如下反应制得:3CH4+2(HB=NH)3+6H2O=3CO2+6H3BNH3。
(1)基态B原子的价电子排布式为_____,B、C、N、O第一电离能由大到小的顺序为_____,CH4、NH3、CO2的键角按照由大到小的顺序排列为_____。
Ⅱ.氢气的安全贮存和运输是氢能应用的关键。
(1)印度尼赫鲁先进科学研究中心的Datta和Pati等人借助ADF软件对一种新型环烯类储氢材料(C16S8)进行研究,从理论角度证明这种材料的分子呈平面结构(如图),每个杂环平面上下两侧最多可吸附10个H2分子。
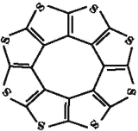
①S的基态原子中能量最高的电子,其原子轨道呈_____形。
②C16S8与H2微粒间的作用力是_____。
③C16S8分子中C原子和S原子的杂化轨道类型分别为_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】初始温度为t ℃,向三个密闭的容器中按不同方式投入反应物,发生如下反应:4HCl(g)+O2(g)![]() 2Cl2(g)+2H2O(g) ΔH=-116kJ·mol-1,测得反应的相关数据如下:
2Cl2(g)+2H2O(g) ΔH=-116kJ·mol-1,测得反应的相关数据如下:
容器 | 容器类型 | 初始体积 | 初始压强/Pa | 反应物投入量/mol | 平衡时Cl2的物质的量/mol | |||
HCl | O2 | Cl2 | H2O | |||||
I | 恒温恒容 | 1L |
| 4 | 1 | 0 | 0 | 1 |
II | 绝热恒容 | 1L | p2 | 0 | 0 | 2 | 2 | a |
III | 恒温恒压 | 2L | p3 | 8 | 2 | 0 | 0 | b |
下列说法正确的是( )
A.反应4HCl(g)+O2(g)![]() 2Cl2(g)+2H2O(l)的ΔH>-116 kJ·mol-1
2Cl2(g)+2H2O(l)的ΔH>-116 kJ·mol-1
B.a>1, b>2
C.p2=1.6×105Pa,p3=4×105Pa
D.若起始向容器Ⅰ中充入0.5 mol HCl、0.5 mol O2、0.5 mol Cl2和0.5 mol H2O,则反应向逆反应方向进行
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素W、X、Y、Z的原子序数依次递增,a、b、c、d、e、f是由这些元素组成的化合物,a的一种重要用途为清洁能源,d是淡黄色粉末,m为元素Y的单质,通常为无色无味的气体。上述物质的转化关系如图所示。下列说法错误的是( )
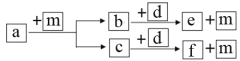
A.简单离子半径:Z<Y
B.阴离子的还原性:Y>W
C.简单气态氢化物的热稳定性:Y>X
D.W2Y2中含有非极性键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA代表阿伏加德罗常数的值。下列说法正确的是( )
A.100mL1mol/LAl2(SO4)3溶液中,所含Al3+的数目为0.2NA
B.100mL1mol/L氨水中,所含NH![]() 的数目为0.1NA
的数目为0.1NA
C.将1molN2和3molH2充入密闭容器,一定条件下充分反应,得到2NA个NH3分子
D.已知2H2(g)+O2(g)=2H2O(g) ΔH=-484kJ/mol,若反应放出242kJ热量,则形成2NA个共价键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】羰基硫(COS)可用作粮食熏蒸剂,可由CO和H2S在一定条件下反应制得。在2L的密闭容器中发生反应CO(g)+H2S(g)![]() COS(g)+H2(g),有关数据如表所示:
COS(g)+H2(g),有关数据如表所示:
实验编号 | 温度/℃ | 起始时物质的量/mol | 平衡时物质的量/mol | |
n(CO) | n(H2S) | n(CO) | ||
① | 150 | 10 | 10 | 7 |
② | 400 | 20 | 20 | 16 |
下列说法正确的是( )
A.②中CO的平衡转化率为80%
B.400℃时该反应的平衡常数K=![]()
C.该反应是吸热反应
D.①中反应10min达到平衡,0~10min的平均反应速率:v(CO)=0.3mol/(Lmin)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】H是一种重要的化工原料,它可由石油和煤焦油通过下列路线合成:
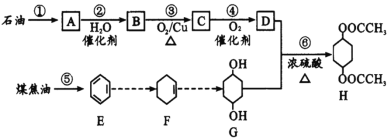
(1)A的名称是____;过程①是____变化(填“物理”或“化学”,下同),过程⑤是_______变化。
(2)反应③的化学方程式为_______;反应⑥的类型为_________。
(3)鉴别E与F的方法是_________________。
(4)H中六元环上的氢原子被两个氯原子取代后的有机物有___种。
查看答案和解析>>
科目:高中化学 来源: 题型:
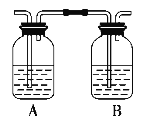
【题目】某化学兴趣小组用下图所示装置进行探究实验制取乙烯并验证乙烯具有不饱和性。当温度迅速上升后,可观察到试管中溴水褪色,烧瓶中浓H2SO4与乙醇的混合液体变为棕黑色。

(1)写出该实验中制取乙烯的化学方程式:_____________________。
(2)验证乙烯具有不饱和性的化学方程式是:_________________________
(3)甲同学认为:考虑到该混合液体反应的复杂性,溴水褪色的现象不能证明反应中有乙烯生成且乙烯具有不饱和性,其理由正确的是________(填字母序号)。
A.乙烯与溴水易发生取代反应
B.使溴水褪色的反应,未必是加成反应
C.使溴水褪色的物质,未必是乙烯
D.乙醇被氧化生成的气体产物,也会使溴水褪色
(4)乙同学对上述实验装置进行了改进,在Ⅰ和Ⅱ之间增加如图装置,则A中的试剂应为________,其作用是________,B中的试剂为________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com