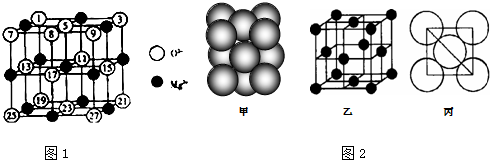
(1)镁、铜等金属离子是人体内多种酶的辅因子.工业上从海水中提取镁时,先制备无水氯化镁,然后将其熔融电解,得到金属镁.
①以MgCl
2为原料用熔融盐电解法制备镁时,常加入NaCl、KCl或CaCl
2等金属氯化物,其主要作用除了降低熔点之外还有
.
②已知MgO的晶体结构属于NaCl型,MgO晶胞中Mg和O的配位数分别为
、
;某同学画出的MgO晶胞结构示意图如图1所示,请指出图中错误
.
③Mg是第三周期元素,该周期部分元素氟化物的熔点见下表:解释表中氟化物熔点差异的原因:
.
| 氟化物 | NaF | MgF2 | SiF4 |
| 熔点/K | 1266 | 1534 | 183 |
(2)铝单质的晶胞结构如图2甲所示,原子之间相对位置关系的平面图如图丙所示.若已知铝原子半径为d,N
A表示阿伏加德罗常数,摩尔质量为M,则该晶体的密度可表示为
;据上图计算,铝原子采取的面心立方堆积的空间利用率为
.
(3)氢能被视作连接化石能源和可再生能源的重要桥梁;氢的规模化储运是氢能应用的关键.氨硼烷化合物(NH
3BH
3)是最近密切关注的一种新型化学氢化物储氢材料.请画出含有配位键(用“→”表示)的氨硼烷的结构式
;与氨硼烷互为等电子体的有机小分子是
(写结构简式).


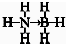 ;等电子体具有相同的电子数目和原子数目,与氨硼烷互为等电子体的有机小分子是CH3CH3,故答案为:
;等电子体具有相同的电子数目和原子数目,与氨硼烷互为等电子体的有机小分子是CH3CH3,故答案为: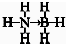 ; CH3CH3;
; CH3CH3;


 补充习题江苏系列答案
补充习题江苏系列答案 学练快车道口算心算速算天天练系列答案
学练快车道口算心算速算天天练系列答案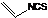 是一种天然植物杀虫剂,其中N原子的杂化方式为sp3
是一种天然植物杀虫剂,其中N原子的杂化方式为sp3