
|
已知:SO32一+I2+H2O=SO42一+2H++2I一,某溶液中可能含有I一、NH4+、Cu2+、SO32-,向该无色溶液中加入少量溴水,溶液仍呈无色,则下列关于泼溶液组成的判断正确的是 | |
A. |
肯定不含I- |
B. |
肯定不含Cu2+ |
C. |
可能含有SO32-,也可能不含 |
D. |
可能含有I- |
 小学学习好帮手系列答案
小学学习好帮手系列答案 小学同步三练核心密卷系列答案
小学同步三练核心密卷系列答案科目:高中化学 来源: 题型:阅读理解
| 实验操作 | 预期的现象及结论 |
| 步骤1:取1mL0.1mol/L Na2SO3和1mL0.1mol/L KI溶液于试管中,混合后滴入2~3滴新制氯水,振荡. | |
| 步骤2: 向试管中加入足量的1mol?L-1HCl后再滴入 数滴(少许)1mol?L-1BaCl2,振荡试管. 或向试管中滴入少量淀粉溶液,振荡试管 向试管中加入足量的1mol?L-1HCl后再滴入 数滴(少许)1mol?L-1BaCl2,振荡试管. 或向试管中滴入少量淀粉溶液,振荡试管 |
若有白色沉淀产生,则说明还原性:SO32->I-, 若没有白色沉淀产生,则说明还原性:I->SO32-. 或若不变蓝色,说明还原性:SO32->I-, 若变蓝色,说明还原性:I->SO32-. 若有白色沉淀产生,则说明还原性:SO32->I-, 若没有白色沉淀产生,则说明还原性:I->SO32-. 或若不变蓝色,说明还原性:SO32->I-, 若变蓝色,说明还原性:I->SO32-. |
| 步骤3:取1mL0.1mol/L KI和1mL0.1mol/LFeCl2溶液于试管中,混合后滴入2~3滴新制氯水,振荡. | |
步骤4: 向试管中滴入少量淀粉溶液,振荡试管. 或向试管中滴入少量10%KSCN溶液,振荡试管. 向试管中滴入少量淀粉溶液,振荡试管. 或向试管中滴入少量10%KSCN溶液,振荡试管. |
若不变蓝色,说明还原性:Fe2+>I-, 若变蓝色,说明还原性:I->Fe2+.或若不变红色,说明还原性:I->Fe2+, 若变红色,说明还原性:Fe2+>I-. 若不变蓝色,说明还原性:Fe2+>I-, 若变蓝色,说明还原性:I->Fe2+.或若不变红色,说明还原性:I->Fe2+, 若变红色,说明还原性:Fe2+>I-. |
查看答案和解析>>
科目:高中化学 来源: 题型:
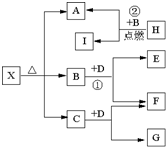 Ⅰ、有A、B、C、D、E五种短周期元素,它们的原子序数依次增大,A元素的原子是半径最小的原子.B元素的最高价氧化物的水化物与其氢化物反应生成一种盐X,D与A同族,且与E同周期,E元素的最外层电子数是次外层电子数的
Ⅰ、有A、B、C、D、E五种短周期元素,它们的原子序数依次增大,A元素的原子是半径最小的原子.B元素的最高价氧化物的水化物与其氢化物反应生成一种盐X,D与A同族,且与E同周期,E元素的最外层电子数是次外层电子数的| 3 |
| 4 |
 NH3?H2O+H+
NH3?H2O+H+ NH3?H2O+H+
NH3?H2O+H+
| ||
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
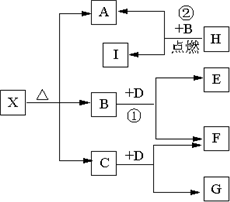 Ⅰ有A、B、C、D、E五种短周期元素,它们的原子序数依次增大,A元素的原子是半径最小的原子.B元素的最高价氧化物的水化物与其氢化物反应生成一种盐X,D与A同族,且与E同周期,E元素的最外层电子数是次外层电子数的
Ⅰ有A、B、C、D、E五种短周期元素,它们的原子序数依次增大,A元素的原子是半径最小的原子.B元素的最高价氧化物的水化物与其氢化物反应生成一种盐X,D与A同族,且与E同周期,E元素的最外层电子数是次外层电子数的| 3 | 4 |
 2MgO+C
2MgO+C 2MgO+C
2MgO+C查看答案和解析>>
科目:高中化学 来源: 题型:
已知:SO32一+I2+H2O=SO42一+2H++2I一,某溶液中可能含有I一、NH4+、Cu2+、SO32一,向该无色溶液中加入少量溴水,溶液仍呈无色,则下列关于该溶液组成的判断正确的是( )
A.肯定不含I一 B.肯定不含Cu2+
C.可能含有SO32一,也可能不含 D.可能含有I一
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com