
| A. | 碳酸盐 | B. | 钾盐 | C. | 酸式盐 | D. | 正盐 |
 53随堂测系列答案
53随堂测系列答案科目:高中化学 来源: 题型:选择题
| A. | ①④ | B. | ③② | C. | ④ | D. | ③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
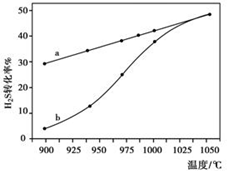 n内反应速率v(H2)=$\frac{0.4c}{t}$mol/(L•min)(用含c、t的代数式表示).
n内反应速率v(H2)=$\frac{0.4c}{t}$mol/(L•min)(用含c、t的代数式表示).| 流程1:气化炉中产生H2 | 流程2:燃烧炉中CaO再生 |
| 通入水蒸气,主要化学反应: I:C(s)+H2O(g)?CO(g)+H2(g) K1 II:CO(g)+H2O(g)?CO2(g)+H2(g) K2 III:CaO(s)+CO2(g)?CaCO3(s) K3 | 通入纯氧,主要化学反应: IV:C(s)+O2(g)=CO2(g)△H=-393.8kJ•mol-1 V:CaCO3(s)=CaO(s)+CO2(g) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | FeCl3溶液中加入铁粉:Fe3++Fe=2Fe2+ | |
| B. | 将NH3通入H2SO4溶液中:NH3+H+=NH4+ | |
| C. | FeCl2溶液中通入Cl2:Fe2++Cl2=Fe3++2Cl- | |
| D. | H2SO4溶液与Ba(OH)2溶液混合:H++OH-=H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
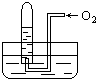 如图所示,试管中盛装的是红棕色气体,当倒扣在盛有水的水槽中时,试管内水面上升,但不能充满试管;当向试管内鼓入氧气后,可以观察到试管中水面继续上升,经过多次重复后,试管被水充满,则原来试管中盛装的气体是( )
如图所示,试管中盛装的是红棕色气体,当倒扣在盛有水的水槽中时,试管内水面上升,但不能充满试管;当向试管内鼓入氧气后,可以观察到试管中水面继续上升,经过多次重复后,试管被水充满,则原来试管中盛装的气体是( )| A. | 肯定是NO2气体 | B. | 肯定是O2与NO2的混合气体 | ||
| C. | 肯定是NO与O2的混合气体 | D. | 可能是NO与NO2的混合气体 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 铁、铜均为日常生活中常见的金属,有着广泛的用途.请回答下列问题:
铁、铜均为日常生活中常见的金属,有着广泛的用途.请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
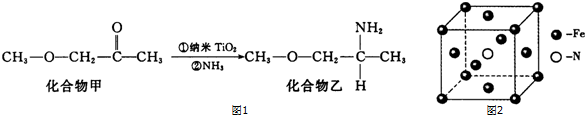
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com