
| A. | 碳酸钠(固体) | B. | 水 | ||
| C. | 硫酸钾溶液 | D. | 10 mL1mol•L-1 H2SO4 |
分析 根据反应的实质为Zn+2H+═Zn2++H2↑,为了减缓反应速率,但又不影响生成氢气的总量,则减小氢离子的浓度但不能改变氢离子的物质的量即可,注意Zn过量,以此来解答.
解答 解:A.碳酸钠与酸反应,生成氢气的量减少,故A错误;
B.加入水,氢离子的物质的量不变,浓度变小,则减缓反应进行的速率,但又不影响生成氢气的总量,故B正确;
C.加适量的硫酸钾溶液,相当于稀释,氢离子的物质的量不变,浓度变小,则减缓反应进行的速率,但又不影响生成氢气的总量,故C正确;
D.加入硫酸,浓度不变,反应速率不变,但生成氢气的量增大,故D错误.
故选BC.
点评 本题考查影响化学反应速率的因素,明确浓度对反应速率的影响即可解答,选项A为学生解答中的难点,题目难度不大.


 学练快车道快乐假期寒假作业系列答案
学练快车道快乐假期寒假作业系列答案科目:高中化学 来源: 题型:解答题
 二甲醚是一种重要的清洁燃料,也可替代氟利昂作制冷剂等,对臭氧层无破坏作用.工业上可利用煤的气化产物(水煤气)合成二甲醚.请回答下列问题:
二甲醚是一种重要的清洁燃料,也可替代氟利昂作制冷剂等,对臭氧层无破坏作用.工业上可利用煤的气化产物(水煤气)合成二甲醚.请回答下列问题:| 物质 | CH3OH | CH3OCH3 | H2O |
| 浓度/(mol•L-1) | 0.44 | 0.6 | 0.6 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH2=CH2+H-OH$\frac{\underline{催化剂}}{△}$CH3-CH2-OH | |
| B. | CH2=CH-CH=CH2+2H2$\frac{\underline{\;催化剂\;}}{\;}$CH3-CH2-CH2-CH3 | |
| C. |  +H2$\stackrel{催化剂}{→}$CH3-CH2-OH +H2$\stackrel{催化剂}{→}$CH3-CH2-OH | |
| D. | CH3-CH3+2Cl2$\stackrel{光照}{→}$CH2Cl-CH2Cl+2HCl |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 常溫下,向100mL 0.0lmol/L HA的溶液中逐滴加入0.02mo1/L MOH 溶液,如图所示,曲线表示流合溶液的pH变化情况(溶液体积 变化忽略不计),下列说法中正确的是( )
常溫下,向100mL 0.0lmol/L HA的溶液中逐滴加入0.02mo1/L MOH 溶液,如图所示,曲线表示流合溶液的pH变化情况(溶液体积 变化忽略不计),下列说法中正确的是( )| A. | HA为一元强酸,NOH为一元强碱 | |
| B. | N点水的电离程度小于K点水的电离程度 | |
| C. | K点所示溶液中c(A-)>c(M+) | |
| D. | K点对应的溶液中,有c(MOH)+c(M+)=0.01mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
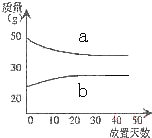
| A. | a挥发、b吸水 | B. | a升华、b冷凝 | C. | a蒸发、b潮解 | D. | a冷凝、b吸水 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com