
【题目】25℃时,若体积为Vm、pH=m的某一元强酸与体积Vn、pH=n的某一元强碱混合,恰好中和,且已知Vm<Vn和m=0.5n,请填写下列空白:
(1)m值可否等于3(填“可”或“否”)______ ,其理由是____________________________。
(2)m值可否等于5(填“可”或“否”)______ ,其理由是____________________________。
(3)25℃时m的取值范围是_________________。
(4)若温度升高至100 ℃时,100体积pH1 = m的某强酸溶液与1体积pH2 = n的某强碱溶液混合后溶液呈中性,则混合前,pH1与pH2之间应满足的关系是____________________。
【答案】 否 若m=3,则n=6,溶液显酸性,与题意不符,故m≠3 否 若m=5,c(H+)m=10-5 mol·L-1,则n=10,c(OH)n=10-4 mol·L-1,![]() =
=![]() >1不符合题意,故m≠5
>1不符合题意,故m≠5 ![]() <m<
<m<![]() pH1+pH2 = 14,或m+n = 14
pH1+pH2 = 14,或m+n = 14
【解析】(1)若m=3,则n=6,25℃时,溶液显酸性,与题中pH=n的某一元强碱不符,所以m≠3;
(2)若m=5,酸溶液中c(H+)m=10-5 mol·L-1,则n=10,碱溶液中c(OH)n=10-4mol·L-1,恰好中和,则有Vm10-m=Vn10n-14,![]() =
=![]() >1,不符合题意,故m≠5;
>1,不符合题意,故m≠5;
(3)![]() =
=![]() =
=![]() =10(m+n-14)<1,所以(m+n-14)<0,而m=0.5n,即3m<14,m<
=10(m+n-14)<1,所以(m+n-14)<0,而m=0.5n,即3m<14,m<![]() ,又pH=n=2m>7,m>
,又pH=n=2m>7,m>![]() ,所以
,所以![]() <m<
<m<![]() 。
。
(4)强酸溶液的pH1=m,体积为100V,溶液中氢离子浓度为:10-mmol/L;碱溶液的pH2=n,体积为V,溶液中氢氧根离子的浓度为:10-(12-n)mol/L,混合后溶液呈中性,则满足溶液中氢离子的物质的量大于氢氧根离子的物质的量,即10-amol/L×100VL=10-(12-n)mol/L×VL,
解得:2-m=n-12,m+n=14,即pH1+pH2=14。


科目:高中化学 来源: 题型:
【题目】高氯酸、硫酸、硝酸和盐酸都是强酸,其酸性在水溶液中差别不大。以下是某温度下这四种酸在冰醋酸中的电离常数:
酸 | HClO4 | H2SO4 | HCl | HNO3 |
Ka | 1.6×10-5 | 6.3×10-9 | 1.6×10-9 | 4.2×10-10 |
从以上表格中判断以下说明中不正确的是( )
A. 在冰醋酸中这四种酸都没有完全电离
B. 在冰醋酸中高氯酸是这四种酸中最强的酸
C. 在冰醋酸中硫酸的电离方程式为H2SO4===2H++SO42-
D. 水对于这四种酸的强弱没有区分能力,但醋酸可以区分这四种酸的强弱
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二甲醚(DME)被誉为“21世纪的清洁燃料”。由合成气制备二甲醚的主要原理如下:① CO(g)+2H2(g)![]() CH3OH(g) △H 1=-90.7 kJ·mol-1
CH3OH(g) △H 1=-90.7 kJ·mol-1
② 2CH3OH(g)![]() CH3OCH3(g)+H2O(g) △H 2=-23.5 kJ·mol-1
CH3OCH3(g)+H2O(g) △H 2=-23.5 kJ·mol-1
③ CO(g)+H2O(g)![]() CO2(g)+H2(g) △H 3=-41.2kJ·mol-1
CO2(g)+H2(g) △H 3=-41.2kJ·mol-1
回答下列问题:
(1)则反应3H2(g)+3CO(g)![]() CH3OCH3(g)+CO2(g)的△H=______kJ·mol-1。
CH3OCH3(g)+CO2(g)的△H=______kJ·mol-1。
(2)下列措施中,能提高CH3OCH3产率的有__________。
A.使用过量的CO B.升高温度 C.增大压强
(3)将合成气以n(H2)/n(CO)=2通入1 L的反应器中,一定条件下发生反应:
4H2(g)+2CO(g) ![]() CH3OCH3(g)+H2O(g) △H,其CO的平衡转化率随温度、压强变化关系如图1所示,下列说法正确的是___________。
CH3OCH3(g)+H2O(g) △H,其CO的平衡转化率随温度、压强变化关系如图1所示,下列说法正确的是___________。
A.△H <0
B.若在P3和316℃时,起始时n(H2)/n(CO)=3,则达到平衡时,CO转化率小于50%
C. △S<0
D.P1<P2<P3
(4)采用一种新型的催化剂(主要成分是Cu-Mn的合金),利用CO和H2制备二甲醚。观察图2回答问题。催化剂中n(Mn)/n(Cu)约为___________时最有利于二甲醚的合成。
(5)图3为绿色电源“二甲醚燃料电池”的工作原理示意图,a电极的电极反应式为__________

(6)甲醇液相脱水法制二甲醚的原理是:CH3OH +H2SO4→CH3HSO4+H2O,CH3 HSO4+CH3OH→CH3OCH3+H2SO4。与合成气制备二甲醚比较,该工艺的优点是反应温度低,转化率高,其缺点是_________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某校化学兴趣小组同学取锌粒与浓H2SO4充分反应制取SO2气体,待锌粒全部溶解后,同学们准备用收集到的气体(X)准备做实验,但是老师说收集到的气体(X)可能含有杂质。
(1)该化学兴趣小组制得的气体(X)中混有的主要杂质气体可能是________(填化学式),写出此过程所发生的2个化学反应方程式:_______________________; ______________________。
(2)一定质量的Zn与87.5mL 16.0mol/L浓硫酸充分反应,反应后称量剩余锌发现质量减少了78g,产生SO2体积(标准状况下)= _____________L。
(3)为证实相关分析,该小组的同学设计了如下图所示的实验装置,对此气体(X)取样进行认真研究(遇有气体吸收过程,可视为全吸收)。

①酸性KMnO4溶液的作用是__________________;B中添加的试剂是_____________。
②装置C中所装药品为________________,可证实气体X中混有较多量某杂质气体的实验现象是_______________________________________。
(4)实验室中某些气体的制取、收集及尾气处理装置如下图所示(省略夹持和净化装置)。仅用此装置和表中提供的物质完成相关实验,最合理的选项是 (_____)
(_____)
选项 | a物质 | b物质 | c收集的气体 | d中的物质 |
A | 浓氨水 | NaOH | NH3 | H2O |
B | 浓硫酸 | Na2SO3 | SO2 | 澄清石灰水 |
C | 稀硝酸 | Cu | NO2 | H2O |
D | 浓盐酸 | KMnO4 | Cl2 | NaOH溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据相应的图像,判断下列相关说法正确的是( )

aX(g)+bY(g)![]() cZ(g) I2(s)+aG(g)
cZ(g) I2(s)+aG(g)![]() bR(g)
bR(g)

aA+bB![]() cC A+2B
cC A+2B![]() 2C+3D
2C+3D
A. t1时改变某一条件,如图所示,则改变的条件一定是加入催化剂
B. 反应达到平衡时,外界条件对平衡的影响如图所示,则该反应为放热反应
C. 从加反应物开始,物质的百分含量与温度的关系如图,则该反应为吸热反应
D. 反应速率和反应条件的变化如图所示,则该反应为放热反应,若A、B、C是气体,则D为固体或液体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关物质性质与用途具有对应关系的是( )
A.常温下铁不与浓硫酸反应,可用钢瓶储运浓硫酸
B.二氧化硫具有氧化性,可用作造纸的漂白剂
C.碳酸氢钠溶液具有弱碱性,可用于制胃酸中和剂
D.浓硫酸具有脱水性,可用于干燥氯气
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某含硫酸铜、硫酸亚铁、硫酸铁的混合溶液100 mL,已知溶液中各种阳离子的物质的量相等,硫酸根离子的浓度为7 mol·L-1。此溶液最多能溶解铁粉的质量为
A. 5.6 g B. 10.6 g C. 11.2 g D. 16.8 g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Na2S2O4俗称保险粉,大量用于漂白纸张和印染工业。某学习小组用下列方法制备该物质。
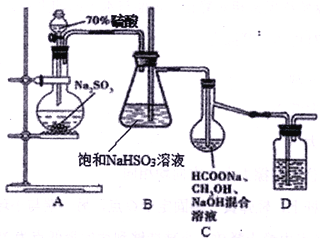
①把甲酸溶于甲醇溶液,再和足量的NaOH溶液混合配成溶液;
②制取SO2并通入上述溶液中,一段时间后可获得保险粉。
(已知:Na2S2O4在水中溶解度较大,在甲醇中溶解度较小)装置如上图所示
(1)A装置中反应的化学方程式为__________________________,为了液体顺利下滴A装置中的分液漏斗改为__________(仪器名称)更合适。
(2)B装置的作用为_____________________________, D中盛放的试剂为 ___________________。
(3)C装置的主要玻璃仪器名称为_________,足量SO2气体通入混合溶液中,生成保险粉的同时生成一种气体,则C中反应的化学方程式为______________________________。
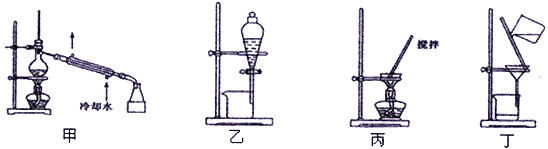
(4)分离C装置中产品Na2S2O4时应选用下列装置__________(填甲、乙、丙、丁,下同),回收甲醇的装置为_______________________。
(5)保险粉在空气中容易吸收氧气而发生氧化.其方程式可能为:
①2 Na2S2O4+O2+2H2O=4NaHSO3 或②Na2S2O4+O2+H2O=NaHSO3+NaHSO4
请设计实验证明氧化时有反应②发生:__________________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com