

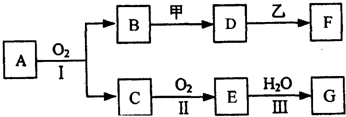
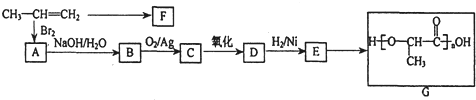
分析 该装置为乙醇催化氧化的实验装置,装置中:装置E制备氧气,装置A提供乙醇蒸气,装置B是乙醇蒸气和氧气在催化剂作用下发生氧化反应生成乙醛和水,C处放置白色的无水硫酸铜,白色粉末无水硫酸铜遇水变蓝色检验水的生成,干燥管D中盛有碱石灰,防止F中的水蒸气进入硬质玻璃管中,干扰C处的实验,装置F通入氢氧化铜中加热出现砖红色沉淀检验乙醛的生成,
(1)依据装置图可知E是提供氧气的装置,加热E处固体,目的是制氧气;
(2)乙醇沸点小于100°C,为使A中乙醇平稳汽化成乙醇蒸气,可以采取水浴加热试管A;D处使用碱石灰的作用是防止水蒸气进入C,影响生成水的检验;
(3)乙醇催化氧化可以生成乙醛;
(4)C处放置白色的无水硫酸铜,白色粉末无水硫酸铜遇水变蓝色,乙醛与新制的氢氧化铜发生氧化还原反应生成砖红色的氧化亚铜.
解答 解:(1)依据装置图可知E是提供氧气的装置,加热E处固体,目的是制氧气,若E处是KClO3与MnO2的混合物,KClO3在MnO2的催化剂作用下分解生成氯化钾和氧气,2KClO3$\frac{\underline{\;MnO_{2}\;}}{△}$2KCl+3O2↑,
故答案为:获得氧气;2KClO3$\frac{\underline{\;MnO_{2}\;}}{△}$2KCl+3O2↑;
(2)直接加热时,生成乙醇蒸汽的速率较大,乙醇和氧化铜反应不完全,造成资源浪费,为了使A中的乙醇平稳气化成蒸气,可采用水浴加热的方法;
乙醇和氧化铜反应生成乙醛、铜和水,加热F处时,F装置中的水蒸气也使无水硫酸铜变蓝,所以对乙醇和氧化铜反应生成的水蒸气造成干扰,所以D装置目的是吸收F装置中的水蒸气,防止F处产生的水蒸气对无水硫酸铜产生影响.
故答案为:略高于78℃的热水浴加热;防止F中的水蒸气进入硬质玻璃管中;
(3)乙醇中含-OH,能发生催化氧化生成乙醛,其反应方程式为:2CH3CH2OH+O2$→_{△}^{Cu}$2CH3CHO+2H2O,
故答案为:2CH3CH2OH+O2$→_{△}^{Cu}$2CH3CHO+2H2O;
(4)白色粉末无水硫酸铜遇水变蓝色能检验水的生成,乙醇蒸气和氧气在催化剂作用下发生氧化反应生成乙醛和水,C处放置白色的无水硫酸铜遇水变蓝色,装置F放置氢氧化铜,乙醛与新制的氢氧化铜发生氧化还原反应生成砖红色的氧化亚铜,
故答案为:白色固体变蓝;产生砖红色沉淀.
点评 本题考查了乙醇的化学性质,实验过程分析判断,可以根据所学知识进行回答,题目难度不大.


 七星图书口算速算天天练系列答案
七星图书口算速算天天练系列答案 初中学业考试导与练系列答案
初中学业考试导与练系列答案科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 丙氨酸与苯丙氨酸脱水,最多可以生成3种二肽 | |
| B. | 对苯二甲酸(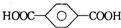 )与乙二醇(HOCH2CH2OH)能通过加聚反应制取聚酯纤维 )与乙二醇(HOCH2CH2OH)能通过加聚反应制取聚酯纤维( 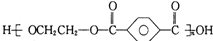 ) ) | |
| C. | 迷迭香酸的结构为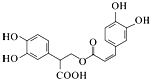 它可以发生酯化、水解、加成、取代、氧化等反应 它可以发生酯化、水解、加成、取代、氧化等反应 | |
| D. | 分子式为C5H12O的醇,能在铜催化下被O2氧化为醛的同分异构体有5种 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 已知C-C键可以绕键轴自由旋转,结构简式为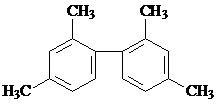 分子中至少有11个碳原子处于同一平面上 分子中至少有11个碳原子处于同一平面上 | |
| B. | 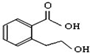 能发生的反应类型有:加成反应、取代反应、消去反应、酯化反应、水解反应 能发生的反应类型有:加成反应、取代反应、消去反应、酯化反应、水解反应 | |
| C. | 3-甲基-3-乙基戊烷的一氯取代产物为5种 | |
| D. | 相同条件下乙酸乙酯在水中的溶解度比在乙醇中的溶解度要大 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 族 周期 | IA | IIA | IIIA | IVA | VA | VIA | VIIA | 0 |
| 2 | ⑤ | ⑥ | ⑦ | ⑧ | ||||
| 3 | ① | ③ | ④ | ⑨ | ||||
| 4 | ② |
 .
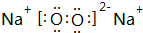
.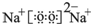 ,该物质所含化学键类型离子键、共价键,0.1mol X与水反应转移电子数为:0.1NA
,该物质所含化学键类型离子键、共价键,0.1mol X与水反应转移电子数为:0.1NA查看答案和解析>>
科目:高中化学 来源: 题型:填空题
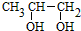 ,D
,D ;
; ;
;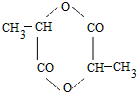 ;
;查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com