
下列有关Fe2(SO4)3溶液的叙述正确的是
A.该溶液中,K+、Fe2+、C6H5OH、Br-可以大量共存
B.和KI溶液反应的离子方程式:Fe3++2I-===Fe2++I2
C.1L 0.1mol/L该溶液和足量的Zn充分反应,生成11.2 g Fe
D.和Ba(OH)2溶液反应的离子方程式: Fe3++SO42-+Ba2++3OH-===Fe(OH)3↓+BaSO4↓
科目:高中化学 来源:2014-2015学年江苏省南通、扬州、连云港高三第二次调研测试化学试卷(解析版) 题型:选择题
下列实验操作与预期实验目的或所得实验结论不一致的是
选项 | 实验操作 | 实验目的或结论 |
A | 将Al2(SO4)3、NaOH溶液相互滴加 | 鉴别Al2(SO4)3、NaOH溶液 |
B | 向AgCl悬浊液中滴入少量KI溶液,有黄色沉淀生成 | 说明KSP(AgCl)>KSP(AgI) |
C | 向NaHS溶液中滴入酚酞,溶液变红色 | HS-水解程度大于电离程度 |
D | 向某溶液中滴加氯水,再滴加KSCN溶液,溶液变成红色 | 该溶液中一定含有Fe2+ |
查看答案和解析>>
科目:高中化学 来源:2014-2015学年湖南省怀化市高三第二次模拟考试理综化学试卷(解析版) 题型:填空题
[化学──选修2 :化学与技术](15分)工业上以黄铁矿(FeS2)为原料,采用接触法生产硫酸的流程图如下。
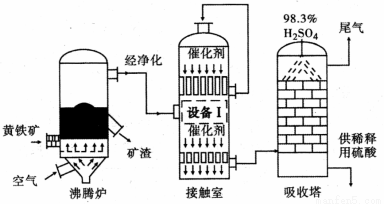
(1)黄铁矿在沸腾炉中反应的化学方程式为 。
(2)为充分利用反应放出的热量,接触室中应安装 (填“设备Ⅰ ”的名称)。
(3)原料气在一定条件下通入接触室中,测量各截面过程气体流中各种气体的物质的量的百分含量如下,则该过程中SO2的平衡转化率为 (精确到 0. l )。
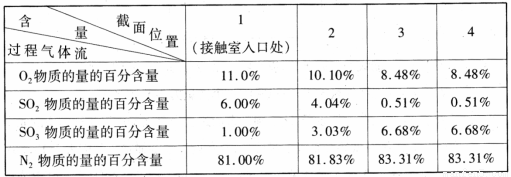
(4)在吸收塔中将SO3转化成硫酸,使用98.3 %的硫酸从上方喷淋,而不使用水的理由是 。吸收塔中填充有许多瓷管,其作用是 。
(5)尾气中常含有N2、O2 、SO2、微量的SO3等。为了综合利用尾气,可将其通人氨水中,再按一定比例加人碳酸氢铵,降低温度析出含结晶水的晶体。已知该结晶水合物的相对分子质量为134 , 则其化学式为 。
(6)能用于测定硫酸尾气中SO2含量的是 (填标号)。
A.NaOH溶液、酚酞试液 B.KMnO4溶液、稀H2SO4
C.碘水、淀粉溶液 D.氨水、酚酞试液
查看答案和解析>>
科目:高中化学 来源:2014-2015学年云南省毕业生复习统一检测理综化学试卷(解析版) 题型:选择题
向100 mL稀硫酸和稀硝酸的混合溶液中逐渐加入铁粉,产生气体的体积(相同状况)随铁粉质量增加的变化如图所示。下列分析错误的是.
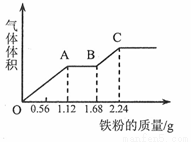
A.原混合酸溶液的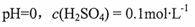
B.OA段的反应为:
C.AB段的反应为: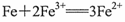
D.BC段气体产物为氢气
查看答案和解析>>
科目:高中化学 来源:2014-2015学年天津市七校高三4月联考化学试卷(解析版) 题型:简答题
(共16分)Ⅰ.CO和H2作为重要的燃料和化工原料,有着十分广泛的应用。
(1)已知:C(s)+O2(g)=CO2(g) △H1= -393.5 kJ·mol-1
C(s)+H2O(g)= CO(g)+H2(g) △H2= +131.3 kJ·mol-1
则反应CO(g)+H2(g)+O2(g)=H2O(g)+CO2(g)△H= kJ·mol-1。
(2)利用反应CO(g) +H2(g)+O2(g) = CO2(g) +H2O(g)设计而成的MCFS燃料电池是用水煤气(CO和H2物质的量之比为1:1)作负极燃气,空气与CO2的混合气为正极助燃气,用一定比例的Li2CO3和Na2CO3低熔点混合物做电解质的一种新型电池。现以该燃料电池为电源,以石墨作电极电解饱和NaCl溶液,反应装置以及现象如图所示。则有:

①燃料电池即电源的N极的电极反应式为 _______________________ ;
②已知饱和食盐水的体积为1 L,一段时间后,测得左侧试管中气体体积为11.2 mL(标准状况),若电解前后溶液的体积变化忽略不计,而且电解后将溶液混合均匀,则此时溶液的pH为 。
Ⅱ.CO和NO是汽车尾气的主要污染物。消除汽车尾气的反应式之一为:
2NO(g)+2CO(g)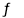 N2(g)+2CO2(g)。请回答下列问题:
N2(g)+2CO2(g)。请回答下列问题:
(3)一定温度下,在一体积为VL的密闭容器中充人一定量的NO和CO时,反应进行到t时刻时达到平衡状态,此时n(CO)=amol、n(N0)=2amol、n(N2)=bmol,且N2占平衡混合气体总体积的1/4。
①该反应的平衡常数K= (用只含a、V的式子表示)
②判断该反应达到平衡的标志是____(填序号)
A.v(CO2)生成=v(CO)消耗
B.混合气体的平均相对分子质量不再改变
C.混合气体的密度不再改变
D.NO、CO、N2、CO2的物质的量浓度均不再变化
(4)在一定温度下,将2.0molNO、2.4molCO通入固定容积2L的密闭中,反应过程中部分物质的物质的量变化如图所示,则:

①有害气体NO的转化率是 ,0~15minCO2的平均反应速率v(CO2)=____(保留小数点后三位)
②20min时,若改变反应条件,导致CO浓度减小,则改变的条件是 。(填序号)。
A.增加CO的量 B.加入催化剂
C.减小CO2的量 D.扩大容器体积
查看答案和解析>>
科目:高中化学 来源:2014-2015学年天津市河西区高三下学期总复习质量调查(二)化学试卷(解析版) 题型:实验题
(18分)锡及其化合物在生产、生活中有着重要的用途。已知:Sn的熔点为231℃;Sn2+易水解、易被氧化;SnCl4极易水解、熔点为-33 ℃、沸点为114 ℃。请按要求回答下列相关问题:
(1)元素锡比同主族碳的周期数大3,锡的原子序数为_________。
(2)用于微电子器件生产的锡粉纯度测定:①取1.19 g试样溶于稀硫酸中(杂质不参与反应),使Sn完全转化为Sn2+;②加入过量的Fe2(SO4)3;③用0.1000 mol/L K2Cr2O7溶液滴定(产物中Cr呈+3价),消耗20.00 mL。步骤②中加入Fe2(SO4)3的作用是___________;此锡粉样品中锡的质量分数_____________。
(3)用于镀锡工业的硫酸亚锡(SnSO4)的制备路线如下:
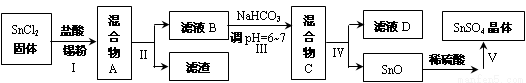
①步骤Ⅰ加入Sn粉的作用: ________________________________及调节溶液pH。
②步骤Ⅱ用到的玻璃仪器有烧杯、_______________、______________。
③步骤Ⅲ生成SnO的离子方程式:____________________________________。
④步骤Ⅳ中检验SnO是否洗涤干净的操作是______________________________,证明已洗净。
⑤步骤Ⅴ操作依次为 _____________、____________、过滤、洗涤、低温干燥。
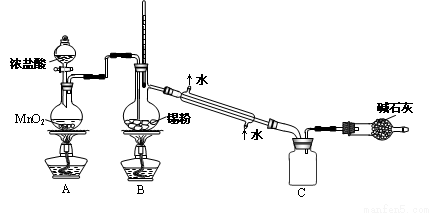
(4)SnCl4蒸气遇氨及水汽呈浓烟状,因而可制作烟幕弹,其反应的化学方程式为__________________。
实验室欲用下图装置制备少量SnCl4 (夹持装置略),该装置存在明显缺陷,改进方法是__________。
利用改进后的装置进行实验,当开始装置C中收集到有SnCl4时即可熄灭B处酒精灯,反应仍可持续进行的理由是_____________________________________。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年天津市河西区高三下学期总复习质量调查(二)化学试卷(解析版) 题型:选择题
下列说法不正确的是
A.仅用酸性高锰酸钾溶液可区分苯和甲苯
B.仅用氯化铁溶液可区分苯酚稀溶液和甘油
C.仅用硝酸银溶液可验证卤代烃中卤原子的种类
D.仅用溴的四氯化碳溶液可区别液态的植物油和动物油
查看答案和解析>>
科目:高中化学 来源:2014-2015学年四川省高三下学期第二次月考化学试卷(解析版) 题型:选择题
在25 ℃时,将0.2 mol CH3COONa晶体和0.1 mol HCl气体同时溶解于同一烧杯的水中,制得1 L溶液,若此溶液中c(CH3COO-)>c(Cl-),则下列判断不正确的是
A.该溶液的pH小于7
B.c(CH3COOH)+c(CH3COO-)=0.20 mol·L-1
C.c(CH3COO-)+c(OH-)=0.10 mol·L-1
D.c(CH3COOH)<c(CH3COO-)
查看答案和解析>>
科目:高中化学 来源:2014-2015学年上海市闵行区高三下学期质量调研考试(二模)化学试卷(解析版) 题型:选择题
反应2NO2(g) N2O4(g) + 57 kJ,若保持气体总质量不变。在温度为T1、T2时,平衡体系中NO2的体积分数随压强变化曲线如图所示。下列说法正确的是
N2O4(g) + 57 kJ,若保持气体总质量不变。在温度为T1、T2时,平衡体系中NO2的体积分数随压强变化曲线如图所示。下列说法正确的是
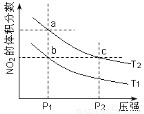
A.a、c两点气体的颜色:a浅,c深
B.a、c两点气体的平均相对分子质量:a>c
C.b、c两点的平衡常数:Kb=Kc
D.状态a通过升高温度可变成状态b
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com