
向1 L仅含Fe2+、I-、Br-的溶液中通入适量氯气,溶液中这三种离子的物质的量的变化如图所示,下列说法中正确的是

A.线段Ⅲ表示Fe2+的变化情况 B.线段Ⅰ表示Br-的变化情况
C.原溶液中c(FeBr2)=4 mol·L-1 D.a数值等于6
科目:高中化学 来源:2016届福建省高三上学期期中测试化学试卷(解析版) 题型:选择题
食品保鲜所用的“双吸剂”,是由还原剂、生石灰、氯化钠、炭粉等按一定比例组成的混合物,可吸收氧气和水。下列分析不正确的是( )
A.“双吸剂”中的生石灰有吸水作用
B.“双吸剂”吸收氧气时,发生了原电池反应
C.吸收氧气的过程中,铁作原电池的负极
D.炭粉上发生的反应为:O2+4e-+4H+=2H2O
查看答案和解析>>
科目:高中化学 来源:2015-2016学年湖南常德石门第一中学高二上期中文化学卷(解析版) 题型:填空题
胃酸过多的病人可服用适量的小苏打以减轻不适感。
(1)写出小苏打和盐酸反应的化学方程式 。
(2)氢氧化铝也是一种胃酸中和剂,西药“胃舒平”的主要成分就是氢氧化铝。
请写出氢氧化铝中和胃酸的离子方程式 。
(3)内科医生给胃酸过多的胃溃疡病人(胃壁受损伤而变薄)开药方时,应选用小苏打和氢氧化铝中的哪一种 ,理由是 。
查看答案和解析>>
科目:高中化学 来源:2016届吉林省高三上第三次模拟考试理综化学试卷(解析版) 题型:选择题
按如图所示装置连接,X、Y均为惰性电极,常温下,当Zn极质量减少3.25g时,X极生成气体840mL(标准状况),若此时烧杯中溶液的体积为500mL,则此时烧杯中溶液的pH(不考虑生成气体溶于水及与溶液的反应)( )
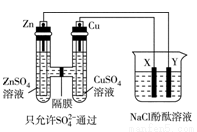
A.11 B.12 C.13 D.14
查看答案和解析>>
科目:高中化学 来源:2015-2016学年湖南常德石门第一中学高二上期中理化学卷(解析版) 题型:选择题
下列说法正确的是
A.室温下,将pH=3的醋酸溶液稀释到原体积的10倍后,溶液的pH=4
B.相同温度下,将足量氯化银固体分别加入:① 蒸馏水、 ② 0.1 mol·L-1氯化镁溶液、③ 0.1 mol·L-1盐酸、④ 0.1 mol·L-1硝酸银溶液中,充分溶解后Ag+浓度:①> ③=④>②
C.室温下,pH=3的CH3COOH溶液与pH=11的NaOH溶液等体积混合后溶液的pH<7
D.为确定某酸H2A是强酸还是弱酸,可测定室温时NaHA溶液的pH。若pH>7,则H2A是弱酸;若pH<7,则H2A是强酸
查看答案和解析>>
科目:高中化学 来源:2016届江西省高三上学期期中测试化学试卷(解析版) 题型:选择题
下列离子方程式不正确的是 ( )
A.0.5mol/L的NaHSO3溶液与1.0mol/L的NaClO溶液等体积混合:HSO3-+ClO-=SO42-+Cl-+H+
B.氢氧化铁溶于氢碘酸中:2Fe(OH)3+6H++2I-=2Fe2++I2+6H2O
C.漂白粉溶液中加氯化铁溶液产生大量红褐色沉淀:Fe3++3ClO-+3H2O=Fe(OH)3↓+3HClO
D.NH4HSO4的稀溶液中逐滴加入Ba(OH)2溶液至SO42—恰好沉淀完全:NH4++H++SO42-+Ba2++2OH-=NH3?H2O+BaSO4↓+H2O
查看答案和解析>>
科目:高中化学 来源:2016届辽宁省分校高三上学期12月月考理综化学试卷(解析版) 题型:选择题
用NA表示阿伏加德罗常数,下列说法正确的是( )
①18g D2O含有的电子数为10NA
②同温、同压下,相同体积的氟气和氩气所含的原子数相等
③标准状况下,11.2L以任意比例混合的氮气和氧气所含的原子数为NA
④在标准状况下,22.4LSO3的物质的量为1mol
⑤4℃时5.4mL的水所含的原子总数为0.9NA
⑥60gSiO2晶体中含有2 NA个Si—O键
⑦1mol Na2O2与水完全反应时转移电子数为2NA
⑧200mL 1mol/L Al2(SO4)3溶液中,Al3+和SO42-离子总数为NA
A.③⑤⑥⑧ B.①②④⑦ C.③⑤ D.③④⑤⑥
查看答案和解析>>
科目:高中化学 来源:2015-2016学年广西柳州铁路第一中学高二上段考理化学卷(解析版) 题型:填空题
I.计算(以下均为常温下)(1)pH=2的H2SO4溶液中水电离出的c(H+)=__________
(2)pH=2的NH4Cl溶液中水电离出的c(H+)=__________
(3) pH=2的H2SO4溶液与pH=5 H2SO4以体积比1:9混合,混合后溶液的pH=_________
(4) pH=12的NaOH溶液与pH=4的 H2SO4混合后溶液呈中性,则V(NaOH):V(H2SO4)= _________
II.25 ℃时,部分物质的电离平衡常数如表所示:
化学式 | CH3COOH | H2CO3 | HClO |
电离平衡常数 | 1.7×10-5 | K1=4.3×10-7 K2=5.6×10-1 1 | 3.0×10-8 |
请回答下列问题:
(1)CH3COOH、H2CO3、HClO的酸性由强到弱的顺序为__________________
(2)同浓度的CH3COO-、HCO 3-、CO32-、ClO-结合H+的能力由强到弱的顺序为___________
3-、CO32-、ClO-结合H+的能力由强到弱的顺序为___________
(3)体积为10 mL pH=2的醋酸溶液与一元酸HX分别加水稀释至1 000 mL,稀释过程中pH变化如图所示,则HX的电离平衡常数______(填“大于”、“等于”或“小于”)醋酸的电离平衡常数;理由是__________________________________________。
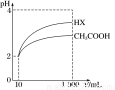
查看答案和解析>>
科目:高中化学 来源:2015-2016学年广东广州执信中学高二上期中文化学试卷(解析版) 题型:?????
可以用于鉴别淀粉溶液和蛋白质溶液的方法是( )
A.分别加入碘水,观察颜色反应
B.分别加热,观察是否生成沉淀
C.加入淀粉酶观察是否水解
D. 分别加入KI溶液,观察颜色反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com