
【题目】把a mol C2H4跟b mol H2在密闭容器中,在适当条件下,反应达到平衡时生成了p mol C2H6 , 若将所得平衡混合气体混合气体,生成CO2和H2O,所需氧气的物质的量应是( )
A.(3a+0.5b)mol
B.(3a+0.5b)mol
C.(3a+0.5b+3p)mol
D.(3a+0.5b﹣3p)mol
科目:高中化学 来源: 题型:
【题目】有①![]() 、
、![]() 、
、![]() ②H2、D2、T2 ③石墨、金刚石④科学家们发现氢元素有三种同位素原子四组微粒或物质,回答下列问题:
②H2、D2、T2 ③石墨、金刚石④科学家们发现氢元素有三种同位素原子四组微粒或物质,回答下列问题:
(1)分别写出氢元素三种同位素的名称:______、_______、______。写出用做制造氢弹原料的同位素原子:______(填原子符号)。
(2)互为同位素的是________(填编号,下同)。
(3)互为同素异形体的是_______。
(4)由①和④中微粒能结合成三原子化合物,写出这些化合物的相对分子质量的最大值和最小值是_____________。
(5)质量相同的H216O 和D216O 所含质子数之比为_______,中子数之比为_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚氯酸钠(![]() )是一种强氧化性漂白剂,广泛用于纺织、印染和食品工业。它在碱性环境中稳定存在。某同学查阅资料后设计生产
)是一种强氧化性漂白剂,广泛用于纺织、印染和食品工业。它在碱性环境中稳定存在。某同学查阅资料后设计生产![]() 的主要流程如下:
的主要流程如下:
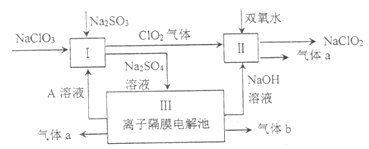
(1)I中发生反应的还原剂是________(填化学式)。
(2)II中反应的离子方程式是_________。
(3)III中离子隔膜电解池的装置如下:
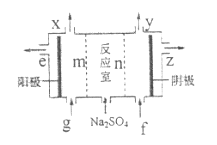
①A的化学式是_________,A在_________口产生。
②m为_______(填“阴”、“阳”)离子交换膜。
③结合化学用语和文字说明解释![]() 产生的原因:_________。
产生的原因:_________。
(4)![]() 是一种高效水处理剂,可用亚氯酸钠和稀盐酸为原料制备:
是一种高效水处理剂,可用亚氯酸钠和稀盐酸为原料制备: ![]()
①该反应中氧化剂和还原剂的物质的量之比是_________。
②研究表明:若反应开始时盐酸浓度越大,则气体产物中![]() 的含量越大,运用氧化还原反应规律分析其原因是___________。
的含量越大,运用氧化还原反应规律分析其原因是___________。
(5)![]() 变质可分解为
变质可分解为![]() 和
和![]() 。取等质量变质前后的
。取等质量变质前后的![]() 试样均配成溶液,分别与足量
试样均配成溶液,分别与足量![]() 溶液反应时,消耗
溶液反应时,消耗![]() 的物质的量前者_______(填>、<、=)后者。
的物质的量前者_______(填>、<、=)后者。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某固体混合物可能由SiO2、Fe2O3、Fe、Na2SO3、Na2CO3、BaCl2中的两种或两种以上的物质组成。某兴趣小组为探究该固体混合物的组成,设计的部分实验方案如下图所示:

下列说法正确的是( )
A. 气体A是SO2和CO2的混合气体
B. 固体A一定含有SiO2,可能含有BaSO4
C. 该固体混合物中Fe2O3和Fe至少有其中一种
D. 该固体混合物一定含有Fe、Na2SO3、BaCl2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】分离混合物在工业生产中应用广泛.某含有金属钨(W)、WO2、WO3、W2O5的混合物,欲从该混合物中分离出WO3和W2O5,并冶炼金属钨,其流程如图所示.
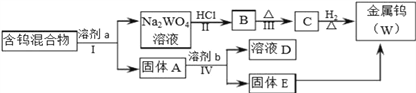
请阅读资料卡片并回答下列问题.
【资料卡片】
i.WO3易溶于NaOH、Na2CO3和Na2C2O4(草酸钠)溶液并形成钨酸盐(Na2WO4);W2O5易被氧化,也能溶解在上述溶液中;金属钨和WO2不溶于上述溶液.
ii.WO3几乎不与无机酸反应.
iii.钨化合物在不同溶剂中的浸取率见下表(浸取是用溶剂溶解固体混合物,以分离可溶性组分及残渣的过程.若浸取率为100%,则固体中的可溶组分全部溶解在溶剂中).
溶剂 | 煮沸时间(min) | W2O5(%) | WO3(%) | WO2 | 金属钨 |
①100g/L NaOH ②300g/LNa2CO3 ③50g/L Na2CO3 ④饱和Na2C2O4 ⑤饱和Na2C2O4(在CO2气氛下浸取) | 25 7 30 60 120 | 72.3 76.4 100 4.2 <0.5 | 100 100 100 100 100 | 未 检 出 | 未 检 出 |
(1)步骤Ⅰ和Ⅳ均要进行的操作是____________________________________________。
(2)WO3既属于金属氧化物,也属于__________(填“酸性”、“碱性”)氧化物,与NaOH溶液反应的离子方程式是__________________________________________________。
(3)步骤Ⅰ是将WO3分离出来,选用的试剂a是⑤,理由是___________________________。
(4)步骤Ⅳ可将W2O5分离出来,选用的试剂b是_______________,固体E中含有的物质是_______________,D中的溶质是_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某溶液含有Fe3+、Al3+、Ba2+、Ag+、K+五种阳离子,现用过量的H2SO4、NaOH、NH3·H2O、NaCl四种溶液,按图所示步骤分开五种离子。下列判断正确的是

A.沉淀乙是氢氧化铝和氢氧化银的混合物
B.溶液3中含有Al3+
C.试剂①是NaCl,试剂④是H2SO4
D.溶液4含有三种阳离子,分别是H+、Na+、K+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知X,Y,Z,E,F五种常见物质含有同一元素M,在一定条件下它们有如图转化关系,Z是NO,下列推断不合理的是( ) 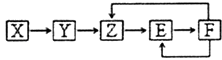
A.X可能是一种氢化物
B.X生成Z一定是化合反应
C.E可能是一种有色气体
D.F中M元素的化合价可能为+5
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据已学知识,请你回答下列问题:
(1)写出原子序数最小的第Ⅷ族元素原子的原子结构示意图 .
(2)写出3p轨道上有2个未成对电子的元素的符号: .
(3)该元素被科学家称之为人体微量元素中的“防癌之王”,其原子的外围电子排布式为4s24p4 , 该元素的名称是 .
(4)已知下列化学键的键能:Si﹣O:460kJ/mol,Si﹣Si:175kJ/mol,O=O:498kJ/mol,则反应:Si+O2=SiO2的反应热△H= .
(5)写出二氧化硫和水合氢离子中S原子,O原子分别采用和杂化形式,其空间构型分别为和 .
(6)用氢键表示法表示HF水溶液中的所有氢键、、、 .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com