
 =1.00 mol?L-1��c��Na+��=
=1.00 mol?L-1��c��Na+��= =1.50 mol?L-1��
=1.50 mol?L-1��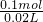 =5.00mol?L-1��c��Al3+��=
=5.00mol?L-1��c��Al3+��=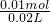 =0.5mol?L-1��
=0.5mol?L-1�� =1.00 mol?L-1��c��Na+��=
=1.00 mol?L-1��c��Na+��= =1.50 mol?L-1������ȷ��
=1.50 mol?L-1������ȷ��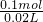 =5.00mol?L-1��c��Al3+��=
=5.00mol?L-1��c��Al3+��=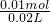 =0.5mol?L-1����D����
=0.5mol?L-1����D����


| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A��һ������Mg2+��Al3+��Cl��������Na+��NH4+ | B��һ������Na+��Mg2+��Cl��������NH4+�����ܺ���Al3+ | C��c ��Cl���� Ϊ 4.00 mol?L-1��c ��Al3+�� Ϊ1.00 mol?L-1 | D��c ��Mg2+�� Ϊ 1.00 mol?L-1��c��Na+�� Ϊ 1.50 mol?L-1 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2012-2013ѧ�꽭��ʡ�߶�1��ѧҵˮƽģ����ԣ��ģ���ѧ�Ծ��������棩 ���ͣ�ѡ����
ij��Һ�п��ܺ�������5�������е�ij���֣�Na+��NH4+��Mg2+��Al3+��Cl����Ϊȷ�ϸ���Һ��ɽ�������ʵ�飺��ȡ20.0 mL����Һ������25.0 mL 4.00 mol��L-1NaOH��Һ���а�ɫ���������ݼ���ζ���塣���ˡ�ϴ�ӡ�����ó���1.16 g���ٽ���Һϡ����100 mL�������Һ��c(OH��)Ϊ0.20 mol��L-1������ȡ20.0 mL����Һ������������AgNO3��Һ�����ɰ�ɫ����11.48 g���ɴ˿ɵó�����ԭ��Һ��ɵ���ȷ������
A��һ������Mg2+��Al3+��Cl��������Na+��NH4+
B��һ������Na+��Mg2+��Cl��������NH4+�����ܺ���Al3+
C��c (Cl��) Ϊ 4.00 mol��L-1��c (Al3+) Ϊ1.00 mol��L-1
D��c (Mg2+) Ϊ 1.00 mol��L-1��c(Na+ ) Ϊ 0.50 mol��L-1
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com