
分析 (1)NaHCO3为强碱弱酸盐,HCO3-水解使水溶液呈碱性;
(2)NaHSO4固体溶于水显酸性,与NaHCO3溶液反应产生二氧化碳和水;
(3)设NaHSO4为2mol,根据加入Ba(OH)2溶液至呈中性来书写离子方程式;
(4)根据物质的量判断反应程度,进而书写离子方程式.
解答 解:(1)NaHCO3为强碱弱酸盐,HCO3-离子既能水解又能发生电离,溶液呈碱性,说明水解程度大于电离程度,
故答案为:NaHCO3=Na++HCO3-、HCO3-+H2O?H2CO3+OH-;HCO3-?CO32-+H+,且HCO3-水解程度大于电离程度,故溶液呈碱性;
(2)NaHSO4固体溶于水显酸性,与NaHCO3溶液反应产生二氧化碳和水,离子方程式为:H++HCO3-=H2O+CO2↑,故答案为:H++HCO3-=H2O+CO2↑;
(3)设NaHSO4为2mol,加入Ba(OH)2溶液至呈中性时,需1molBa(OH)2,则反应的离子方程式为:2H++SO42-+Ba2++2OH-=BaSO4↓+2H2O,反应后SO42-离子过量,继续加Ba(OH)2溶液,此时发生的离子方程式为SO42-+Ba2+=BaSO4↓,故答案为:2H++SO42-+Ba2++2OH-=BaSO4↓+2H2O;SO42-+Ba2+=BaSO4↓;
(4)设NaHCO3和Ba(OH)2都为1mol,分别发生反应:HCO3-+OH-=H2O+CO32-;CO32-+Ba2+-=BaCO3↓,总反应为:HCO3-+Ba2++OH-=BaCO3↓+H2O,
故答案为:HCO3-+Ba2++OH-=BaCO3↓+H2O.
点评 本题考查盐类的水解和弱电解质的电离以及离子方程式的书写,题目较为综合,但题目难度不大,注意把握与量有关的离子方程式的书写.


科目:高中化学 来源: 题型:选择题
| A. | ①②③ | B. | ①②④ | C. | ②③④ | D. | ②④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Fe+2 H+=Fe3++H2↑ | B. | Fe3++Cu=Cu2++Fe2+ | ||
| C. | Cu+2H+=Cu2++H2↑ | D. | 2Fe3++Fe=3Fe2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ${\;}_{\;}^{13}$O和14O互称同素异形体 | B. | 丙烷和异丁烷互称同系物 | ||
| C. | 金刚石和石墨互称同位素 | D. | 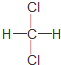 和 和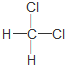 互称同分异构体 互称同分异构体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 盐酸中的c(Cl-)与醋酸溶液中的c(CH3COO-)相等 | |
| B. | 分别与足量CaCO3反应,放出的CO2一样多 | |
| C. | 分别用水稀释相同倍数,n(Cl-)<n(CH3COO-) | |
| D. | 分别将两溶液升温至80℃,醋酸溶液的pH变小,盐酸的pH不变(不考虑挥发) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | l00mL0.4 mol•L-1KNO3溶液 | B. | 100mL0.2mol•L-1Cu(NO3)2溶液 | ||
| C. | 200mLO.l mol•L-1Fe(NO3)2溶液 | D. | 400mLO.l mol•L-1Al(NO3)3溶液 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com