
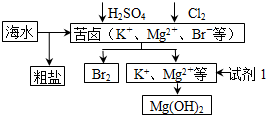
| A. | 工业上,电解熔融MgO冶炼金属镁可减小能耗 | |
| B. | 从苦卤中提取Br2的反应的离子方程式为2Br -+Cl2═2Cl-+Br2 | |
| C. | 试剂1可以选用石灰乳 | |
| D. | 可用BaCl2溶液除去粗盐中的SO42- |
分析 A.工业上电解熔融氯化镁冶炼镁;
B.氯气具有强氧化性,能将溴离子氧化为溴单质;
C.石灰乳和镁离子反应生成氢氧化镁沉淀;
D.硫酸钡不溶于水和酸;
解答 解:A.氧化镁熔点很高,氯化镁熔点较氧化镁低,电解氧化镁冶炼镁增加成本,所以工业上采用电解熔融氯化镁的方法冶炼镁,故A错误;
B.氯气能将溴离子氧化为溴单质,从苦卤中提取Br2的反应的离子方程式为:2Br-+Cl2═2Cl-+Br2,然后采用萃取的方法从溶液中获取溴,故B正确;
C.煅烧贝壳得到CaO,将CaO溶于水得到石灰乳,石灰乳和镁离子反应生成氢氧化镁沉淀,试剂1廉价且原料来源广泛,故C正确;
D.氯化钡和硫酸根离子反应生成难溶性的硫酸钡,且氯离子不是杂质离子,故D正确;
故选A.
点评 本题考查了海水资源的开发和利用,涉及氧化还原反应、除杂、金属的冶炼等知识点,明确物质的性质是解本题关键,知道根据金属活动性强弱选取合适的冶炼方法,题目难度不大.


 培优好卷单元加期末卷系列答案
培优好卷单元加期末卷系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
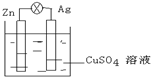 (1)在如图的银锌原电池中,银为正极,电极上发生的是还原反应(“氧化”或“还原”),电极反应式是Cu2++2e-═Cu.锌片上观察到的现象为锌片溶解,电极反应式为Zn-2e-═Zn2+.
(1)在如图的银锌原电池中,银为正极,电极上发生的是还原反应(“氧化”或“还原”),电极反应式是Cu2++2e-═Cu.锌片上观察到的现象为锌片溶解,电极反应式为Zn-2e-═Zn2+.查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
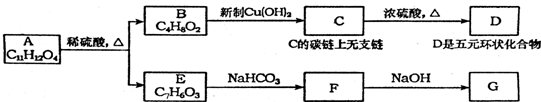
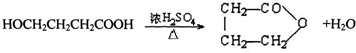 ,反应类型是酯化反应或取代反应.
,反应类型是酯化反应或取代反应.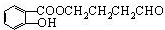 ,E的结构简式是
,E的结构简式是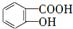 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | a是电源的负极 | |
| B. | B极区电解液为LiOH溶液 | |
| C. | A电极的电极反应式为4OH--4e-=2H2O+O2↑ | |
| D. | 每产生标准状况下2.24L氢气,就有0.1mol阳离子通过交换膜进入阴极区 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com