分析:(1)主族元素的族序数=其最外层电子数=其价电子数,最外层电子在排列时,遵循能量最低原理(先排能量低的后排能量高的),4s的能量小于4p的能量,4s能级最多排两个电子,4p能级最多排6个电子.
(2)化合物中正负化合价的倒数和为0;
(3)判断原子采取杂化方式时,先根据价层电子对互斥理论判断价层电子对,然后再确定采取的杂化方式,如:如果是直线型,采取的就是sr杂化;
(4)分子空间构型的判断:价层电子对数=σ键电子对数+中心原子上的孤电子对数,σ键电子对数=σ键个数=中心原子结合的原子个数,中心原子上的孤电子对数=
(a-xb),以此来解答.
解答:
解:(1)元素周期表每一横行是一个周期,一共有18个纵行,从左向右,1、2和13至17七个纵行是主族,且第一纵行开始分别为第IA族、第IIA族,第IIIA族、第IVA族,V第A族,V第IA族,第VIIA族,Ga是第四横行第十一纵行的元素,所以是第四周期第IIIA族的元素,主族元素的族序数=其最外层电子数=其价电子数,所以Ga最外层有3个电子,最外层电子在排列时,遵循能量最低原理(先排能量低的后排能量高的),4s的能量小于4p的能量,4s能级最多排两个电子,故答案为:4s
24p
1;(2)Fe与CO易形成配合物Fe(CO)
5化合价的代数和为0,CO的化合价的代数和为0,则Fe元素的化合价为0,故答案为:0;
(3)在CH
4中价层电子对数=σ键电子对数(4)+中心原子上的孤电子对数(0),所以碳原子采取sp
3杂化.在CO分子中价层电子对数=σ键电子对数(1)+中心原子上的孤电子对数(1),所以碳原子采取sp杂化.CH
3OH中,价层电子对数=σ键电子对数(4)+中心原子上的孤电子对数(0),所以碳原子采取sp
3杂化,
故答案为:CH
4、CH
3OH;
(4)ED
4-是ClO
4-离子,价层电子对数=σ键电子对数+中心原子上的孤电子对数,σ键电子对数=σ键个数=中心原子结合的原子个数,中心原子是Cl原子,中心原子结合的原子个数是4,所以σ键电子对数=4,中心原子上的孤电子对数=
(7+1-2×4)=0,则Cl为sp
3杂化,空间构型为正四面体;B、C、D、E分别是C、N、O、Cl是四种元素,分子中每个原子最外层都达到8电子稳定结构的判断公式是:化合价的绝对值+原子最外层电子数=8,分子中每个原子最外层都达到8电子稳定结构.否则就没有达到8电子稳定结构.对于C元素,8-原子最外层电子数(4)=化合价的绝对值(4),
对于O元素,8-原子最外层电子数(6)=化合价的绝对值(2),
对于N元素,8-原子最外层电子数(5)=化合价的绝对值(3),
对于Cl元素,8-原子最外层电子数(7)=化合价的绝对值(1),所以两两形成的化合物且每个原子最外层都达到8电子稳定结构的化合物有:CO
2 CCl
4 NCl
3,其电子式分别为为
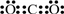
、
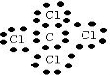
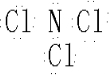
,
故答案为:正四面体;
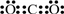
、

.

 如图中实线是元素周期表的部分边界,其中上边界并未用实线标出.根据信息回答下列问题.
如图中实线是元素周期表的部分边界,其中上边界并未用实线标出.根据信息回答下列问题.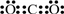 、
、
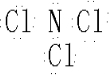 ,
,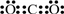 、
、 .
.


 中和热是指酸跟碱发生中和反应生成lmol H2O所放出的热量.某学生想通过测定反应过程中所放出的热量来计算中和热.他将50mL05mol?L-1的盐酸与50mL0.55mol?L-1的NaOH溶液在如图所示的装置中进行中和反应.请回答下列问题:
中和热是指酸跟碱发生中和反应生成lmol H2O所放出的热量.某学生想通过测定反应过程中所放出的热量来计算中和热.他将50mL05mol?L-1的盐酸与50mL0.55mol?L-1的NaOH溶液在如图所示的装置中进行中和反应.请回答下列问题:
 按如图所示装置连接,X、Y均为惰性电极.请回答下列问题:
按如图所示装置连接,X、Y均为惰性电极.请回答下列问题: