
| A. | 聚丙烯的结构简式: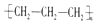 | B. | 丙烷分子的比例模型: | ||
| C. | 乙炔的电子式: | D. | 2-乙基-1,3-丁二烯分子的键线式: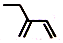 |
分析 A.聚丙烯的结构单元的主链含有2个C原子;
B.图为球棍模型,黑色球代表C原子;
C.乙炔的结构式为H-C≡C-H,C、H之间形成1对共用电子对,C、C之间形成3对共用电子对;
D.键线式表示方法:碳碳键用线段来表现,画出键线式.拐点和端点表示碳原子,碳原子,H不必标出,杂原子(非碳、氢原子)不得省略,并且其上连有的氢也一般不省略;
解答 解:A.聚丙烯为丙烯通过加聚反应生成的,聚丙烯的结构简式为: ,故A错误;
,故A错误;
B.图为丙烷分子的球棍模型为 ,不是比例模型,故B错误;
,不是比例模型,故B错误;
C.乙炔的结构式为H-C≡C-H,C、H之间形成1对共用电子对,C、C之间形成3对共用电子对,其电子式为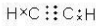 ,故C错误;
,故C错误;
D.2-乙基-1,3-丁二烯的结构简式为 ,键线式中用短线“-”表示化学键,端点、交点表示碳原子,C原子、H原子不需要标出,所以2-乙基-1,3-丁二烯的键线式为:
,键线式中用短线“-”表示化学键,端点、交点表示碳原子,C原子、H原子不需要标出,所以2-乙基-1,3-丁二烯的键线式为: ,故D正确;
,故D正确;
故选:D.
点评 本题考查了化学用语,注意书写结构简式时碳碳三键等官能团不能省略,理解掌握核外电子排布规律是关键,题目难度中等.


 华东师大版一课一练系列答案
华东师大版一课一练系列答案科目:高中化学 来源: 题型:选择题
| A. | 纯碱、烧碱均属碱 | B. | SiO2、CO2均属于酸性氧化物 | ||
| C. | 凡能电离出H+的化合物均属酸 | D. | 非金属氧化物一定是酸性氧化物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na+、CO32- | B. | Na+、HCO3- | C. | CO32-、HCO3- | D. | Na+、OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 二氧化氯具有还原性,可用于自来水的杀菌消毒 | |
| B. | 液氨汽化时要吸收大量的热,可用作制冷剂 | |
| C. | 硫具有还原性,可用硫粉覆盖地上洒落的汞 | |
| D. | 硅是重要的半导体材料,常用于制作光导纤维 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH3-CH═CH-CHO | B. |  | ||
| C. | HOCH2-CH2-CH═CH-CHO | D. |  |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
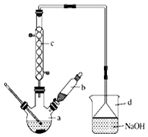 溴苯是一种化工原料,实验室合成溴体的装置示意图及有关数据如表:
溴苯是一种化工原料,实验室合成溴体的装置示意图及有关数据如表:| 苯 | 溴 | 溴苯 | |
| 密度/g•cm-3 | 0.88 | 3.10 | 1.50 |
| 沸点/℃ | 80 | 59 | 156 |
| 水中溶解度 | 微溶 | 微溶 | 微溶 |
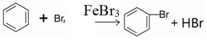 ;装置d的作用吸收HBr和溴蒸气;防止倒吸.
;装置d的作用吸收HBr和溴蒸气;防止倒吸.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用A表示的反应速率是0.4 mol•(L•min)-1 | |
| B. | 2 min内,v正(B)和v逆(C)表示的反应速率的值都是逐渐减小的 | |
| C. | 2 min末的反应速率用B表示是0.3 mol•(L•min)-1 | |
| D. | 分别用B、C、D表示的反应速率其比值是3:2:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com