
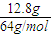 =0.2mol,铜与浓硝酸反应生成NO2,随着反应的进行,硝酸的浓度逐渐降低,稀硝酸与铜反应生成NO,NO2、NO的物质的量共为
=0.2mol,铜与浓硝酸反应生成NO2,随着反应的进行,硝酸的浓度逐渐降低,稀硝酸与铜反应生成NO,NO2、NO的物质的量共为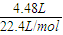 =0.2mol,被还原的硝酸的物质的量等于生成NO2、NO的总的物质的量,硝酸反应后生成硝酸铜、NO和NO2,根据N原子守恒可计算硝酸的物质的量浓度,再根据氧化还原反应得失电子质量守恒计算通入O2的体积.
=0.2mol,被还原的硝酸的物质的量等于生成NO2、NO的总的物质的量,硝酸反应后生成硝酸铜、NO和NO2,根据N原子守恒可计算硝酸的物质的量浓度,再根据氧化还原反应得失电子质量守恒计算通入O2的体积.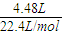 =0.2mol,被还原的硝酸的物质的量等于生成NO2、NO的总的物质的量,为0.2mol,故答案为:0.2;
=0.2mol,被还原的硝酸的物质的量等于生成NO2、NO的总的物质的量,为0.2mol,故答案为:0.2;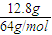 =0.2mol,反应后生成Cu(NO3)2、NO和NO2,且NO和NO2的物质的量总共为
=0.2mol,反应后生成Cu(NO3)2、NO和NO2,且NO和NO2的物质的量总共为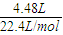 =0.2mol,则反应中消耗HNO3的物质的量为2n(Cu(NO3)2)+n(NO)+n(NO2)=2×0.2mol+0.2mol=0.6mol,所以原硝酸的物质的量浓度为
=0.2mol,则反应中消耗HNO3的物质的量为2n(Cu(NO3)2)+n(NO)+n(NO2)=2×0.2mol+0.2mol=0.6mol,所以原硝酸的物质的量浓度为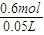 =12mol/L,
=12mol/L,

 53随堂测系列答案
53随堂测系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
(10分)12.8g铜片与50mL某浓度的硝酸恰好完全反应,生成硝酸铜和NO、NO2混合气体,且收集到的混合气体在标准状况下体积为4.48 L; 请计算:
(1)被还原的硝酸的物质的量为__________mol。
(2)求原硝酸的物质的量浓度。
(3)若将收集着气体的集气瓶倒立于足量水中,通入多少升标准状况下的O2,可以使集气瓶中充满溶液?
查看答案和解析>>
科目:高中化学 来源:2011-2012学年浙江省温州八校高一上学期期末考试化学试卷 题型:计算题
(10分)12.8g铜片与50mL某浓度的硝酸恰好完全反应,生成硝酸铜和NO、NO2混合气体,且收集到的混合气体在标准状况下体积为4.48 L;请计算:
(1)被还原的硝酸的物质的量为__________mol。
(2 )求原硝酸的物质的量浓度。
)求原硝酸的物质的量浓度。
(3)若将收集着气体的集气瓶倒立于足量水中,通入多少升标准状况下的O2,可以使集气瓶中充满溶液?
查看答案和解析>>
科目:高中化学 来源:2014届浙江省温州八校高一上学期期末考试化学试卷 题型:计算题
(10分)12.8g铜片与50mL某浓度的硝酸恰好完全反应,生成硝酸铜和NO、NO2混合气体,且收集到的混合气体在标准状况下体积为4.48 L; 请计算:
(1)被还原的硝酸的物质的量为__________mol。
(2)求原硝酸的物质的量浓度。
(3)若将收集着气体的集气瓶倒立于足量水中,通入多少升标准状况下的O2,可以使集气瓶中充满溶液?
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com