
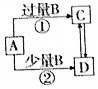
| A�� | ��AΪAlCl3��Һ��B ����Ϊ��ˮ����Ӧ�ٵ����ӷ���ʽΪAl3++4NH3•H2O�TAlO2-+4NH4++2H2O | |
| B�� | ��AΪFe��B����ΪϡHNO3����Ӧ�ڵ����ӷ���ʽΪ3Fe+8H++2NO3-�T3Fe2++2NO��+4H2O | |
| C�� | ��AΪNaOH��Һ��B����ΪCO2������Ca��OH��2��Һ����C��D ��Һ�е������� | |
| D�� | ��AΪCl2��B����ΪNH3��ʵ���ҿ��ü��ȹ���C�ķ�����ȡNH3 |
���� A����ˮΪ�����ܽ��������������߷�Ӧ������������������
B��ϡ������������Ӧ��������������ˮ��NO���壻
C��������̼����ʱ���ɵ�CΪ̼�����ƣ�������̼����ʱ���ɵ�DΪ̼���ƣ�̼���ƺ�̼�����ƶ����������Ʒ�Ӧ��
D����AΪCl2��B����ΪNH3����CΪ�Ȼ�泥��������Ȼ����ܹ���Ӧ�����Ȼ�泥����ݴ���ȡ������
��� �⣺A���Ȼ����백ˮ��Ӧ��������������������ȷ�����ӷ���ʽΪ��Al3++3NH3•H2O=Al��OH��3��+3NH4+����A����
B����AΪFe��B����ΪϡHNO3����Ӧ����������������Ӧ�����ӷ���ʽΪ��3Fe+8H++2NO3-�T3Fe2++2NO��+4H2O����B��ȷ��
C����AΪNaOH��Һ��B����ΪCO2��CΪ̼�����ƣ�DΪ̼���ƣ�̼���ƺ�̼�����ƶ�������������Һ��Ӧ����̼��Ƴ���������Ca��OH��2��Һ��������C����
D����AΪCl2��B����ΪNH3������CΪ�Ȼ�泥����ڰ������Ȼ��ⷴӦ����ͨ�������Ȼ�淋ķ�����ȡNH3����D����
��ѡB��
���� ���⿼�����ӷ���ʽ��д�������Ʊ������Ӽ����֪ʶ��Ϊ�߿��ĸ�Ƶ�⣬��Ŀ�Ѷ��еȣ�ע���������ӷ���ʽ����дԭ����ȷ�������Ʊ����������ӵļ���ԭ����֪ʶ������������ѧ�������Ӧ��������


 ȫ��������ϵ�д�
ȫ��������ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ʵ����
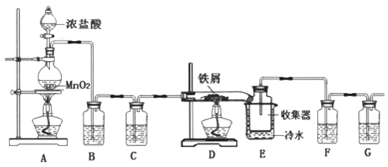
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | 1 mol FeI2������������Ӧʱת�Ƶĵ�����Ϊ2NA | |
| B�� | ��4.9 g H2SO4��4.9 g H3PO4�Ļ����Һ����ԭ����Ϊ0.4NA | |
| C�� | �����£�0.1 mol C2H4�����к����õ��Ӷ���ĿΪ0.6NA | |
| D�� | 25��ʱ��Ksp��BaSO4��=1��10-10����BaSO4������Һ��Ba2+��ĿΪ1��10-5NA |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ����Ʒ�ڳ�ʪ�����и�����ʴ | |
| B�� | �������賣����������ά | |
| C�� | ʵ�����о����˿ɵõ�����̼��ƹ��� | |
| D�� | ����ϩ����ʳƷ��װ���� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
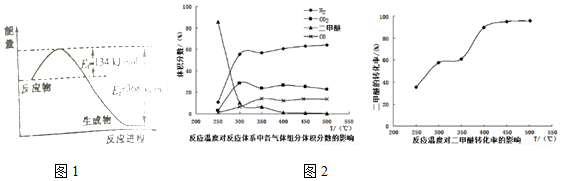
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | 2NaOH+H2SO4�TNa2SO4+2H2O | B�� | 2SO2+O2+2H2O�T2H2SO4 | ||
| C�� | Cu+2H2SO4$\frac{\underline{\;��\;}}{\;}$CuSO4+SO2��+2H2O | D�� | C+2H2SO4��Ũ��$\frac{\underline{\;��\;}}{\;}$2SO2��+CO2��+2H2O |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
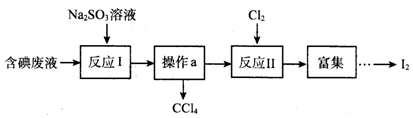
| A�� | ����a���������� | |
| B�� | ��ӦI��II�е�Ԫ�ؾ������� | |
| C�� | ��ԭ��ǿ��˳��SO32-��I-��Cl- | |
| D�� | ����ӦI����25.2g Na2SO3����ӦII���ı�״�������������Ϊ4.48L |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ��Al2O3�����ĩ�ӵ���ˮ�� | |
| B�� | ��CO2���岻��ͨ�˵�NaAlO2��Һ�� | |
| C�� | �������Ľ�����Ͷ�뵽NaAlO2��Һ�� | |
| D�� | ��340ml 1mol/L NaOH��Һ�м���80ml 1mol/L��AlCl3��Һ |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com