
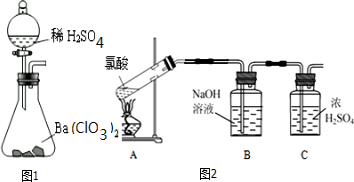
分析 (1)①由图可知仪器的名称;
②由Ba(ClO3)2+H2SO4═BaSO4↓+2HClO3可知,硫酸钡不溶于水;
(2)①氯酸受热分解生成O2和Cl2,Cl2为黄绿色气体,根据A中气体颜色判断生成含有氯气;
②氯气能和水反应生成HCl、HClO,所以氯气能和碱溶液反应;浓硫酸具有吸水性,能干燥气体;
③氧气具有助燃性,可以用带火星的木条检验;
(3)浓度较高的氯酸与铜反应会生成ClO2气体,Cu被氧化生成Cu 2+,该反应中Cl元素化合价由+5价变为+4价、Cu元素化合价由0价变为+2价,根据转移电子守恒配平方程式;
(4)由信息可知,氯酸钠加热分解,且与硝酸银不反应,而NaCl不分解,与硝酸银反应生成白色沉淀.
解答 解:(1)①仪器a的名称是分液漏斗,故答案为:分液漏斗;
②由Ba(ClO3)2+H2SO4═BaSO4↓+2HClO3可知,硫酸钡不溶于水,则将氯酸分离出来的操作方法是过滤,故答案为:过滤;
(2)①氯酸受热分解生成O2和Cl2,Cl2为黄绿色气体,如果A中气体呈黄绿色,所以看到的现象是A中气体呈黄绿色,由此可知氯酸分解的产物中含有Cl2,
故答案为:产生黄绿色气体;Cl2;
②氯气能和水反应生成HCl、HClO,所以氯气能和碱溶液反应,则B的作用是吸收氯气;浓硫酸具有吸水性,能干燥气体,所以C的作用是干燥气体,
故答案为:吸收氯气;干燥气体;
③氧气具有助燃性,可以用带火星的木条检验,所以检验另一种气体的方法是:将带火星的木条放置在C的出气口,如果带火星的木条复燃就证明有氧气生成,
故答案为:将带火星的木条放置在C的出气口;木条复燃;
(3)浓度较高的氯酸与铜反应会生成ClO2气体,Cu被氧化生成Cu 2+,该反应中Cl元素化合价由+5价变为+4价、Cu元素化合价由0价变为+2价,转移电子数为2,根据转移电子守恒配平方程式为Cu+2ClO3-+4H+=Cu2++2ClO2↑+2H2O,
故答案为:Cu+2ClO3-+4H+=Cu2++2ClO2↑+2H2O;
(4)由信息可知,氯酸钠加热分解,且与硝酸银不反应,而NaCl不分解,与硝酸银反应生成白色沉淀,则鉴别二者的方法为①将两种固体物质加热到300℃以上,若有气体产生,证明待鉴物质为NaClO3;②在两种待鉴物质的溶液中分别加入AgNO3溶液,若有白色沉淀产生,证明待鉴物质为NaCl,
故答案为:将两种固体物质加热到300℃以上,若有气体产生,证明待鉴物质为NaClO3;在两种待鉴物质的溶液中分别加入AgNO3溶液,若有白色沉淀产生,证明待鉴物质为NaCl.
点评 本题考查物质的制备实验,为高频考点,把握制备实验原理、物质的性质、物质的鉴别和检验等为解答的关键,侧重分析与实验能力的考查,注意元素化合物知识的综合应用,题目难度中等.


 同步练习河南大学出版社系列答案
同步练习河南大学出版社系列答案 同步练习西南师范大学出版社系列答案
同步练习西南师范大学出版社系列答案 补充习题江苏系列答案
补充习题江苏系列答案 学练快车道口算心算速算天天练系列答案
学练快车道口算心算速算天天练系列答案科目:高中化学 来源: 题型:选择题
| 选项 | 叙述Ⅰ | 叙述Ⅱ |
| A | 溴单质易溶于四氯化碳 | Br2、CCl4均为非极性分子 |
| B | CO2属于非极性分子 | 分子中只存在非极性共价键 |
| C | 氟化氢高温时也难分解 | HF分子之间存在氢键 |
| D | 碘沸点低、易升华 | 分子中的 I-I 键能较小 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 鱼、肉、虾等食品用福尔马林防腐保鲜 | |
| B. | 国际奥委会禁止使用的兴奋剂--麻黄碱 | |
| C. | 向伤口处涂一定浓度的双氧水溶液可以杀菌消毒 | |
| D. | 误食铜、汞、铜等重金属,立即喝牛奶或鸡蛋清解毒 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
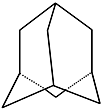 金刚烷的结构如图所示,它可看作是由四个等同的六元环组成的空间构型.
金刚烷的结构如图所示,它可看作是由四个等同的六元环组成的空间构型.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氯乙烷水解制乙醇;丙烯与氯化氢反应 | |
| B. | 乙酸和乙醇制乙酸乙酯;苯与液溴的反应 | |
| C. | 2-氯丙烷制丙烯;由乙炔与溴的反应 | |
| D. | 氯乙烯制聚氯乙烯;由苯乙酸甲酯的水解 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 现使用酸碱中和滴定法测定市售白醋(CH3COOH)的总酸量(g/100mL).
现使用酸碱中和滴定法测定市售白醋(CH3COOH)的总酸量(g/100mL).| 滴定次数 | 1 | 2 | 3 | 4 |
| V(样品) (mL) | 20.00 | 20.00 | 20.00 | 20.00 |
| V(NaOH)(消耗) (mL) | 15.95 | 15.00 | 15.05 | 14.95 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 正极反应式:Ag+Cl--e-=AgCl | |
| B. | 每生成1mol Na2Mn5O10转移2mol电子 | |
| C. | Na+不断向“水”电池的负极移动 | |
| D. | 若用阳离子交换膜,当电路中转移0.2mole-,负极区将减少0.4mol离子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该混合溶液中有:c(Na+)+c(H+)=c(HC2O4-)+c(OH-)+2 c(C2O42-) | |
| B. | 该混合溶液中有:c( Na+)=2[c(HC2O4-)+c(H2C2O4)+c(C2O42-)] | |
| C. | 该混合溶液中有:c(OH-)-c(H+)=c(HC2O4-)+2 c(H2C2O4) | |
| D. | 该混合溶液中有:c(Na+)>c(C2O42-)>c(HC2O4-)>c(OH-)>c(H+) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com