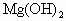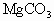A
分析:由选项可知最后溶液为氯化镁溶液,参加反应的盐酸相同,溶液中氯化镁的物质的量相同,根据方程式判断参加反应的各物质的物质的量,判断溶质质量变化,溶液质量越大,溶质的浓度越小,据此判断.
解答:73g10%盐酸含有氯化氢的物质的量为
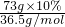
=0.2mol.
A、发生反应Mg(OH)
2+2HCl=MgCl
2+H
2O,根据反应可知0.2molHCl反应,需0.1molMg(OH)
2,溶液增重为Mg(OH)
2的质量为0.1mol×58g/mol=5.8g;
B、发生反应MgO+2HCl=MgCl
2+H
2O,根据反应可知0.2molHCl反应,需0.1molMgO,溶液增重为MgO的质量为0.1mol×40g/mol=4g;
C、发生反应Mg+2HCl=MgCl
2+H
2↑,根据反应可知0.2molHCl反应,需0.1molMg,生成氢气0.1mol,溶液增重为Mg的质量减去生成的氢气的质量为0.1mol×24g/mol-0.1mol×2g/mol=2.2g;
D、发生反应MgCO
3+2HCl=MgCl
2+H
2O+CO
2↑,根据反应可知0.2molHCl反应,需0.1molMgMgCO
3,生成CO
20.1mol,溶液增重为MgCO
3的质量减去生成的CO
2的质量为0.1mol×84g/mol-0.1mol×44g/mol=4g;
所以溶液质量增重为Mg(OH)
2>MgO=MgCO
3>Mg.
溶液中氯化镁的物质的量相同,所以溶液质量越大,氯化镁浓度越小,所以与Mg(OH)
2反应,所得溶液浓度最小.
故选A.
点评:本题考查物质的量浓度比较,难度中等,关键清楚溶质质量相同,溶液质量越大溶质的浓度越小,是对所学知识的综合运用.

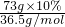 =0.2mol.
=0.2mol.

 阅读快车系列答案
阅读快车系列答案