
| A. | 等于1:2 | B. | 小于1:2 | C. | 等于2:1 | D. | 大于2:1 |
科目:高中化学 来源: 题型:多选题
| A. | 1L0.1mol/L的NaHCO3溶液中,HCO3-、CO32-离子数之和为0.1NA | |
| B. | 44gCO2、N2O组成的混合气体中所含有的原子数为3NA | |
| C. | 36H2中含有的中子数目为24NA | |
| D. | 2.24L(标准状况)O2与钠反应时,转移电子数目可能为0.3NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 规律 | 结论 |
| A | 较强酸可以制取较弱酸 | CO2通入NaClO 溶液中能生成HClO |
| B | 根据溶液的pH与溶液碱性的关系 | pH=6.8的溶液一定显酸性 |
| C | 组成和结构相似的物质,沸点随相对分子质量增大而升高 | H2O沸点低于H2S |
| D | 同主族元素从上至下非金属性减弱 | HF、HCl、HBr、HI的酸性依次减弱 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙烯、苯和乙酸均能发生加成反应 | |
| B. | 某芳香烃的分子式为C10H14,它可使酸性 KMnO4溶液褪色,且分子结构中只有一个侧链,符合条件的烃有4种 | |
| C. | 1 mol的有机物(结构如图)最多能与含5mol NaOH的水溶液完全反应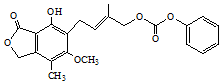 | |
| D. | 油脂皂化反应得到高级脂肪酸与甘油 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 负极反应为:2H2+4OH--4e-═4H2O | |
| B. | 正极反应为:O2+4H++4e-═2 H2O | |
| C. | 电池工作时溶液中的阴离子移向正极 | |
| D. | 电池工作时负极区pH升高,正极区pH下降 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 负极反应式:CH3OH-8e-+8OH-=CO2+6H2O | |
| B. | 电池工作时,CH3OH发生还原反应,被氧化 | |
| C. | 电池工作时,溶液中的阴离子向负极移动 | |
| D. | 电池工作一段时间后,溶液的pH增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1g H2 所含的原子个数 | |
| B. | 4g 氦气所含的原子个数 | |
| C. | 23g 金属 Na 全部转变为金属离子时失去的电子个数 | |
| D. | 16g O2 所含的分子个数 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com