
【题目】下图是利用甲醇燃料电池进行电化学研究的装置图,下列说法正确的是

A. 甲池是化学能转化为电能的装置,总反应式为:2CH3OH+3O2 =2CO2+4H2O
B. 乙池中的Ag不断溶解
C. 反应一段时间后要使乙池恢复原状,可加入一定量Cu(OH)2固体
D. 当甲池中280 mL(标准状况下)O2参加反应时,乙池中理论上可析出1.6g 固体
【答案】D
【解析】
根据装置图,甲池为燃料电池,通甲醇一极为负极,通氧气一极为正极,乙池为电解池装置,石墨连接正极,即石墨一极为阳极,Ag极为阴极,然后根据原电池工作原理、电解原理进行分析;
A、甲池为燃料电池,是将化学能转化成电能,甲池电解质为KOH,CO2与KOH反应生成K2CO3,因此总反应式为2CH3OH+3O2+4KOH=2K2CO3+6H2O,故A错误;
B、甲池中通甲醇一极为负极,Ag与甲池的负极相连,即Ag极为阴极,根据电解原理,Ag极反应式为Cu2++2e-=Cu,Ag极质量增重,故B错误;
C、乙池中电解后生成硫酸、铜和氧气,要想复原,需要加入CuO,故C错误;
D、建立O2~4e-~2Cu,氧气的物质的量为![]() =0.0125mol,m(Cu)=0.0125mol×2×64g·mol-1=1.6g,故D正确。
=0.0125mol,m(Cu)=0.0125mol×2×64g·mol-1=1.6g,故D正确。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】25℃时,草酸溶液中部分微粒的物质的量浓度随NaOH溶液的加入pH 的变化如图所示。其中c (H2C2O4) +c (HC2O4-)+ c (C2O42-)=0.1mol/L,下列说法不正确的是

A. H2C2O4的Ka2数量级为10-5
B. NaHC2O4溶液中,c (Na+)>c(HC2O4-)>c (H+)>c (OH-)
C. 0.1mol/L 的H2C2O4溶液,H2C2O4的电离度为80%
D. pH=7.0的溶液中,c (Na+)=0.1 + c(C2O42-) - c (H2C2O4)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各表述与示意图一致的是
A. 
25℃时,用0.1mol·L-1盐酸滴定20mL 0.1mol·L-1NaOH溶液,溶液的pH随加入酸体积的变化
B. 
10mL 0.01mol·L-1 KMnO4酸性溶液与过量的0.1mol·L-1 H2C2O4溶液混合时,n(Mn2-)随时间的变化
C. 
曲线表示反应2SO2(g)+O2(g) ![]() 2SO3(g) △H<0 正、逆反应的平衡常数K随温度的变化
2SO3(g) △H<0 正、逆反应的平衡常数K随温度的变化
D. 
a、b曲线分别表示反应CH2=CH2(g)+H2(g)→CH3CH3(g) △H<0使用和未使用催化剂时,反应过程中的能量变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:在36 g 碳不完全燃烧所得气体中,CO占1/3体积,CO2占2/3体积,且知C(s) +1/2O2(g) = CO(g) △H = -110.5 kJ/mol CO(g) +1/2O2(g) = CO2(g) △H = -283 kJ/mol,下列说法错误的是
A. 与这些碳完全燃烧相比,碳不完全燃烧损失的热量是 283kJ
B. CO2(g)= C(s) + O2(g) △H = +393.5 kJ/mol
C. 3mol C(s)与2mol O2(g)完全反应放出的热量为614.5 kJ
D. 已知相关的化学键键能数据如下
化学键 | H—H | C—O |
| H—O | C—H |
E/(kJ·mol-1) | 436 | 343 | 1 076 | 465 | 413 |
则CO(g)+2H2(g)![]() CH3OH(g) ΔH= +99 kJ/mol
CH3OH(g) ΔH= +99 kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室要配制500mL 0.2mol·L-1的NaOH溶液,请结合实验回答下列问题:
(1)实验中需称量NaOH固体的质量为_________g。
(2)实验步骤主要有计算、称量、溶解、转移和定容。
①完成上述实验步骤要用到的玻璃仪器有烧杯、量筒、玻璃棒、__________和_________。
②溶解和转移过程中玻璃棒的作用分别是__________和__________。
(3)分析下列操作对所配制溶液浓度的影响(填 “偏高”“偏低”或“无影响”)。
①转移液体过程中有少量液体溅出:__________;
②定容时俯视刻度线:__________;
③容量瓶洗净后,未经干燥处理:__________![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有8种元素的性质、数据如下表所列,它们属于第二或第三周期。
① | ② | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | |
原子半径(10-10m) | 0.74 | 1.60 | 1.52 | 1.10 | 0.99 | 1.86 | 0.75 | 0.82 |
最高或最低化合价 | +2 | +1 | +5 | +7 | +1 | +5 | +3 | |
-2 | -3 | -1 | -3 |
回答下列问题:
(1)③的元素符号是_______________,⑧的元素名称是_______________。①在元素周期表中的位置是(周期、族)_____________。
(2)在最高价氧化物的水化物中,酸性最强的化合物的分子式是________________;名称是____________;碱性最强的化合物的电子式是:_____________________________; 属___________化合物(填“离子”或“共价”)。
(3)比较④和⑦的氢化物的稳定性(用化学式表示)__________________________。
(4)写出⑦的最高价氧化物对应水化物跟它的氢化物反应的化学方程式:_______________________。
(5)写出②最高价氧化物对应水化物跟⑤的氢化物水溶液反应的离子方程式:__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】运用化学知识,对下列内容进行分析不合理的是( )
A. 成语“饮鸩止渴”中的“鸩”是指放了砒霜(![]() )的酒,砒霜有剧毒,具有还原性。
)的酒,砒霜有剧毒,具有还原性。
B. 油脂皂化后可用渗析的方法使高级脂肪酸钠和甘油充分分离
C. 屠呦呦用乙醚从青蒿中提取出治疗疟疾的青蒿素,其过程包含萃取操作
D. 东汉魏伯阳在《周易参同契》中对汞的描述:“……得火则飞,不见埃尘,将欲制之,黄芽为根。”这里的“黄芽”是指硫。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学生用0.1000 mol/L NaOH溶液滴定未知浓度的盐酸溶液,操作可分解为如下几步:
A.用蒸馏水洗干净滴定管;B. 用待测定的溶液润洗酸式滴定管;C.用酸式滴定管取稀盐酸20.00 mL,注入锥形瓶中,加入酚酞;D.另取锥形瓶,再重复操作一次;E.检查滴定管是否漏水;F.取下碱式滴定管用标准的NaOH溶液润洗后,将标准液注入碱式滴定管“0”刻度以上2~3 cm处,再把碱式滴定管固定好,调节液面至“0”刻度或“0”刻度以下;
G.把锥形瓶放在滴定管下面,瓶下垫一张白纸,边滴边摇动锥形瓶直至滴定终点,记下滴定管液面所在刻度。完成以下填空:
(1)正确操作的顺序是(用序号字母填写)_____________。
(2)操作F中应该选择图中________滴定管(填标号)。

(3)滴定时边滴边摇动锥形瓶,眼睛应观察________。
A. 滴定管内液面的变化 B. 锥形瓶内溶液颜色的变化
滴定终点溶液颜色的变化是____________________________。
(4)滴定结果如表所示:
滴定次数 | 待测溶液体积/mL | 标准溶液的体积/mL | |
滴定前刻度 | 滴定后刻度 | ||
1 | 20 | 1.02 | 21.03 |
2 | 20 | 2.00 | 25.00 |
3 | 20 | 0.60 | 20.60 |
滴定中误差较大的是第________次实验,造成这种误差的可能原因是________。
A. 碱式滴定管在装液前未用标准NaOH溶液润洗2~3次
B. 滴定开始前碱式滴定管尖嘴部分有气泡,在滴定终点读数时未发现气泡
C. 滴定开始前碱式滴定管尖嘴部分没有气泡,在滴定终点读数时发现尖嘴部分有气泡
D. 达到滴定终点时,仰视溶液凹液面最低点读数
E. 滴定过程中,锥形瓶摇荡得太剧烈,以致有些液滴飞溅出来
(5)该盐酸的浓度为________mol/L。
(6)如果准确移取20.00 mL 0.1000 mol/L NaOH溶液于锥形瓶中,滴入酚酞指示剂,然后用未知浓度的盐酸(装在酸式滴定管中)滴定,是否也可测定出盐酸的物质的量浓度?________(填“是”或“否”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现代工业常以氯化钠、二氧化碳和氨气为原料制备纯碱,部分工艺流程如下:
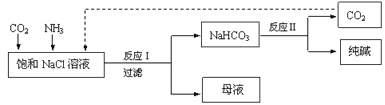
有关说法错误的是
A.反应Ⅰ原理为CO2 + NH3+ NaCl + H2O → NaHCO3↓ + NH4Cl
B.向饱和NaCl溶液中先通入足量的CO2,再通入足量的NH3
C.反应Ⅰ生成的沉淀,经过过滤、洗涤、煅烧可得到纯碱
D.往母液中通入氨气,加入细小的食盐颗粒并降温,可使氯化铵析出
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com