
| A. | 第三周期第IA族 | B. | 第四周期第IA族 | C. | 第三周期第ⅡA族 | D. | 第四周期第ⅡA族 |
分析 金属与酸反应置换出氢气,金属提供电子,根据氧化还原反应电子转移守恒,计算金属原子失去的电子数.结合金属原子失去形成具有Ne原子的电子层结构的离子,确定金属元素的质子数,进而确定金属元素在元素周期表中的位置.
解答 解:氢气的物质的量为$\frac{11.2L}{22.4L/mol}$=0.5mol;
令金属原子失去的电子数为n,根据电子转移守恒有:
1mol×n=0.5mol×2,解得n=1,
金属原子失去1个电子形成的金属离子具有Ne原子的电子层结构的离子,
所以+1价金属离子核外有10个电子,故该金属元素质子数为10+1=11,
即该金属为钠元素,位于周期表第三周期第IA族,
故选:A.
点评 本题考查通过计算推断元素,难度中等,注意从氧化剂、还原剂得失电子的数目关系判断金属元素原子失去电子数目是解题的关键.


科目:高中化学 来源: 题型:选择题
| A. | 银氨溶液:Na+、K+、NO3-、NH3•H2O | |
| B. | 存在Fe2+的溶液中:Mg2+、SO42-、ClO-、Na+ | |
| C. | 氢氧化铁胶体:H+、K+、S2-、Br- | |
| D. | 高锰酸钾溶液:H+、Na+、SO42-、葡萄糖分子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 无色溶液:Al3+、NH4+、Cl-、HCO3- | |
| B. | 使紫色石蕊试纸变红色的溶液:Cl-、NO3-、Fe2+、K+ | |
| C. | 常温下,pH=13的溶液:K+、CO32-、Na+ | |
| D. | c(H+)=0.1mol/L的溶液:CO32-、Na+、HCO3-、Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 95g | B. | 10g | C. | 50g | D. | 100g |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA |
| 1 | ① | ||||||
| 2 | ② | ③ | ④ | ⑤ | |||
| 3 | ⑥ | ⑦ | ⑧ | ⑨ | ⑩ | ||
| 4 | ⑪ | ⑫ |
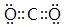 ;元素⑥可形成一种碱性氧化物,用电子式表示该碱性氧化物的形成过程
;元素⑥可形成一种碱性氧化物,用电子式表示该碱性氧化物的形成过程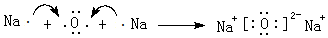 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铝粉投入到NaOH溶液中:2Al+2OH-=2AlO2-+H2↑ | |
| B. | 铁粉加入三氯化铁溶液中:2Fe+Fe3+=3Fe2+ | |
| C. | AlCl3溶液中加入过量氨水:Al3++4OH-→AlO2-+2H2O | |
| D. | FeCl2溶液中加入氯水:Cl2+2 Fe2+=2 Fe3++2Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 测定溶液的pH值,应先将pH试纸用蒸馏水润湿 | |
| B. | 称量加热后的固体时,均需先将固体在空气中冷却后再称量 | |
| C. | 配制0.1mol/LNa2CO3溶液时,容量瓶应先用0.1mol/L Na2CO3润洗 | |
| D. | 除去铁粉中混有的少量铝粉,可加人过量的氢氧化钠溶液,完全反应后过滤、干燥 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 甲醛是一种氧化物 | |
| B. | 甲醛中C、H、O的质量比为6:1:8 | |
| C. | 甲醛分子中含有氢分子 | |
| D. | 甲醛是由一个碳原子和一个水分子构成 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com