
【题目】下列离子方程式中,正确的是
A.氯气通入水中,溶液呈酸性:Cl2 + H2O ![]() 2H+ + Cl-+ ClO-
2H+ + Cl-+ ClO-
B.向氯化铝溶液中加入过量氨水: Al3+ + 4OH-=AlO2-+ 2H2O
C.碳酸氢铵溶液中加足量的氢氧化钠溶液:NH4+ + OH- = NH3↑ + H2O
D.二氧化硫通入溴水中,溴水褪色:SO2 + Br2 + 2H2O = 4H+ + 2Br- + SO42-
 期末复习检测系列答案
期末复习检测系列答案 超能学典单元期中期末专题冲刺100分系列答案
超能学典单元期中期末专题冲刺100分系列答案 黄冈360度定制密卷系列答案
黄冈360度定制密卷系列答案 阳光考场单元测试卷系列答案
阳光考场单元测试卷系列答案 名校联盟冲刺卷系列答案
名校联盟冲刺卷系列答案科目:高中化学 来源: 题型:
【题目】偏二甲肼(C2H8N2)是一种高能燃料,可作为航天运载火箭的推动力。下列叙述正确的是( )
A.偏二甲肼的摩尔质量为60 g
B.6.02×1023个偏二甲肼分子的质量约为60 g
C.常温下,22.4L偏二甲肼气体的含C质量为24g
D.6 g偏二甲肼含有NA个N2 分子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)按如图所示操作,充分反应后:

①Ⅰ中发生反应的离子方程式为_____________________________________________;
②Ⅱ中铜丝上观察到的现象是________________________________________________;
③结合Ⅰ、Ⅱ实验现象可知Fe2+、Cu2+、Ag+的氧化性由强到弱的顺序为______________________。
(2)某一反应体系中有反应物和生成物共5种物质:S、H2S、HNO3、NO、H2O。该反应物中还原产物是____________;若反应方程式中转移了0.3 mol电子,则氧化产物的质量是________g。
(3)将少量Cl2通入FeBr2的溶液中,反应的离子方程式为2Fe2++Cl2===2Fe3++2Cl-,这个事实说明具有还原性的粒子还原性强弱为_________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定条件下,密闭容器中发生反应:A(g)+3B(g) ![]() 2C(g),下列有关说法正确的是
2C(g),下列有关说法正确的是
A.若加入催化剂,则反应的△H 增大
B.加压时,平衡向正反应方向移动,反应的平衡常数增大
C.若反应温度升高,则活化分子的百分数增大,反应速率增大
D.若低温时,该反应为正向自发进行,则△H>0
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】四种短周期元素X、Y、Z、W在周期表中的位置如图所示,其中Z元素的最外层电子数是内层电子总数的1/2。下列说法不正确的是

A.Z元素位于周期表的第3周期第VA族
B.X、W元素的最高价氧化物对应水化物的酸性:W强于X
C.Y元素的气态氢化物的热稳定性比Z的低
D.X与W可形成共价化合物XW2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某强酸性溶液X中仅含有H+、NH4+、Al3+、Ba2+、Fe2+、Fe3+、CO32-、SO32-、SO42-、Cl-、NO3-中的一种或几种(忽略水的电离和离子的水解),取该溶液进行连续实验,实验过程如下:

下列有关推断合理的是
A. 根据上述连续实验不能确定溶液X中是否含有Fe3+
B. 沉淀H为Al(OH)3、BaCO3的混合物
C. 溶液中一定含有H+、Al3+、NH4+、Fe2+、SO42-、Cl-
D. 若溶液X为100 mL,产生的气体A为112 mL(标况),则X中c(Fe2+)=0.05mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有甲、乙、丙三个体积均为2L的恒容密闭容器,按不同投料比Z[![]() 进行反应: 4HCl(g)+O2(g)
进行反应: 4HCl(g)+O2(g)![]() 2Cl2(g)+2H2O(g) △H。在不同温度T条件下达到平衡时,HCl的平衡转化率与Z和T的关系如下表所示。
2Cl2(g)+2H2O(g) △H。在不同温度T条件下达到平衡时,HCl的平衡转化率与Z和T的关系如下表所示。
容器 | 起始时 | 平衡时HCl转化率 | |||
n(HCl)/mol | Z | T=100℃ | T=200℃ | T=300℃ | |
甲 | 0.8 | a | 96% | 94% | 90% |
乙 | 0.8 | b | 46% | 44% | 40% |
丙 | 0.8 | 4 | 95% | 88% | 80% |
下列说法正确的是
A.b<4
B.温度升高时,反应速率减慢,所以转化率下降
C.丙容器中,300℃平衡时,c(O2)=0.04molL-1
D.若甲容器温度在300时需要5min达到平衡,则此时间内v(Cl2)=0.036molL-1min-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】
铜及其化合物在生产生活中有着广泛的应用。请回答下列问题:
(1)铜元素位于元素周期表中第四周期________族,属于元素周期表中________区元素,基态Cu原子有___________种不同能级的电子。
(2)元素铜与镍的第二电离能分别为:ICu=1958 kJ·mol-1、INi=1753 kJ·mol-1, ICu>INi的原因是________________________________________________________。
(3)硫化亚铜和氧化亚铜均为离子晶体,二者比较,熔点较高的是氧化亚铜,原因为_________________________________________。
(4)某含铜化合物的离子结构如图1所示。
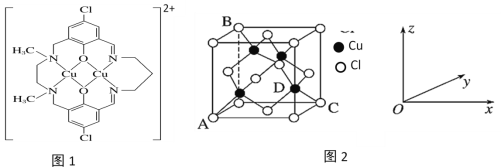
①该离子中存在的作用力有______________(填标号)。
A.离子键 B.共价键 C.配位键 D.氢键 E.范德华力
②该离子中碳原子的杂化类型有____________。
(5)CuCl2和CuCl是铜的两种氯化物。
①图2中表示的是________(填“CuCl2”或“CuCl”)的晶胞。
②原子坐标参数可用来表示晶胞内部各原子的相对位置。图2中各原子坐标参数A为(0,0,0);B为(0,1,1);C为(1,1,0);则D原子的坐标参数为____________。
③已知图2所示晶胞中C、D两原子核间距为298pm,阿伏加德罗常数的值为NA,则该晶体密度为___________________ g·cm-3(列出计算式即可)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】合成某药物的中间体G的流程如图:

请回答下列问题:
(1)A的名称为___(系统命名法),F的分子式为___。反应⑤的反应类型是___。
(2)C中含氧官能团的名称为__。
(3)已知一定条件下2分子乙酸分子间脱水生成1分子乙酸酐,写出该反应的化学方程式:___。
(4)写出满足下列条件的E的同分异构体的结构简式:___。
①苯环上只有三个取代基;
②核磁共振氢谱图中只有4组吸收峰;
③1mol该物质与足量NaHCO3溶液反应生成2molCO2。
(5)根据已有知识并结合相关信息,写出以C6H5—OOCCH2CH3为原料制备 的合成路线流程图(无机试剂任选)。___。
的合成路线流程图(无机试剂任选)。___。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com