
【题目】某氯化钾样品中含有少量K2CO3、K2SO4和不溶于水的杂质。为了提纯KCl,先 将样品溶于适量水中,充分搅拌后过滤,再将滤液按如图所示步骤进行操作。下列说法中正确的是( )

A. 试剂Ⅰ是Ba(NO3)2溶液,试剂Ⅲ是HCl溶液
B. ①②③的操作均为过滤
C. 步骤②中加入试剂Ⅱ的目的是除去Ba2+
D. Y和Z中都含有BaSO4
【答案】C
【解析】
氯化钾样品中含有少量碳酸钾、硫酸钾和不溶于水的杂质,为了提纯氯化钾,由流程可知,溶解后加试剂I为BaCl2,过滤分离出沉淀Y为硫酸钡、碳酸钡,X中含KCl、BaCl2,试剂II为碳酸钾,过滤分离出Z为碳酸钡,W含KCl、碳酸钾,试剂III为盐酸,反应得到Q含KCl、HCl,蒸发结晶得到KCl;
A.由分析知,试剂Ⅰ是BaCl2溶液,不能用Ba(NO3)2溶液,否则会引入杂质NO3-,故A错误;
B.由分析知,操作①、②为过滤,而③的操作为酸化,故B错误;
C.试剂II为碳酸钾,步骤②中加入试剂Ⅱ的目的是除去Ba2+,故C正确;
D.由分析知,Y为硫酸钡、碳酸钡,Z为碳酸钡,故D错误;
答案为C。


科目:高中化学 来源: 题型:
【题目】已知钠、氯及其化合物间有如下转化关系,
请按要求填空:
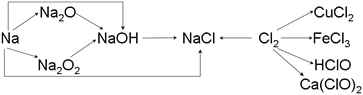
(1)实验室中金属钠通常保存在_______中,一小块金属钠投入水中反应的化学方程式是________________。
(2)Na2O2常用于呼吸面具中,有关反应的化学方程式为_____________________________,_________________________________。
(3)新制的氯水滴入紫色石蕊试液中,观察到的现象是___________________________。
请写出氯气与水反应的化学方程式_______________________________。
(4)工业上用氯气和石灰乳反应制漂白粉,其化学方程式为_____________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数,下列叙述中正确的是( )
A. 标准状况下,3.36LCCl4中含有,7.5NA个原子
B. 常温常压下,32gO2和O3的混合物中含有的氧原子数约为1.204×1024
C. CO2和标准状况下11.2LHCl具有相同的原子数
D. 1L0.1mol/L的CH3COOH溶液中,H+的数目为0.1NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知热化学方程式:2H2(g)+O2(g) ![]() 2H2O(l) H= -571.6 kJ·mol-1,2CH3OH(l)+3O2(g)
2H2O(l) H= -571.6 kJ·mol-1,2CH3OH(l)+3O2(g) ![]() 2CO2(g)+4H2O(l) H= -1452 kJ·mol-1,H+(aq)+OH-(aq)
2CO2(g)+4H2O(l) H= -1452 kJ·mol-1,H+(aq)+OH-(aq) ![]() H2O(l) H= -57.3 kJ·mol-1。据此判断下列说法正确的是
H2O(l) H= -57.3 kJ·mol-1。据此判断下列说法正确的是
A. CH3OH的燃烧热为1452 kJ·mol-1
B. 2H2(g)+O2(g) ![]() 2H2O(g) H > -571.6 kJ·mol-1
2H2O(g) H > -571.6 kJ·mol-1
C. CH3COOH(aq)+NaOH(aq) ![]() H2O(l)+CH3COONa(aq) H= -57.3 kJ·mol-1
H2O(l)+CH3COONa(aq) H= -57.3 kJ·mol-1
D. 2CH3OH(l)+O2(g) ![]() 2CO2(g)+4H2(g) H= -880.4 kJ·mol-1
2CO2(g)+4H2(g) H= -880.4 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA为阿伏加德罗常数的值。下列说法正确的是
A. 密闭容器中,2 mol NO和1molO2充分反应后分子总数为2NA
B. 标准状况下,2.24L甲醇在足量O2中完全燃烧,生成CO2的分子数为0.1NA
C. 常温常压下,28gCO含有的质子数为14NA
D. 常温常压下,30g乙烷含有的共价键数目为6NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2NO2(红棕色)![]() N2O4(无色) ΔH<0。将一定量的NO2充入注射器中并密封,改变活塞位置的过程中,气体透光率随时间的变化如图所示(气体颜色越深,透光率越小)。下列说法不正确的是( )
N2O4(无色) ΔH<0。将一定量的NO2充入注射器中并密封,改变活塞位置的过程中,气体透光率随时间的变化如图所示(气体颜色越深,透光率越小)。下列说法不正确的是( )

A. b点达到了平衡状态
B. b点对应的时刻改变的条件是将注射器的活塞向外拉
C. d点:v(正)<v(逆)
D. 若在c点将温度降低,其透光率将增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示的实验装置可用来测定含两种元素的某种气体 X 的分子式。

在注射器A中装有240mL气体 X 慢慢通过不含空气并装有红热的氧化铜的玻璃 管B,使之完全反应,得到下面的实验结果:
实验前B管重20.32g,实验后B管重20.00g,B管中的黑色粉末变成红色粉末。在C管中收集到的无色液体是水;在注射器D中收集的气体是氮气。试回答下列问题:
(1)X气体是由______(填元素符号)元素组成的。
(2)若240mLX气体完全反应后,收集到的氮气质量是0.28g。根据实验时温度和压强计算 1molX气体的体积是24000mL,则X的摩尔质量是______。
(3)通过计算确定X的分子式为________。
(4)写出B中发生反应的化学方程式__________。(X在该条件下不发生分解反应)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】科学处理NOx、SO2等大气污染物,对改善人们的生存环境具有重要的现实意义。
(1)利用甲烷催化还原氮氧化物。已知:
CH4(g) +4NO2(g) =4NO(g)+CO2(g) +2H2O(g);△H=-574kJmol-1
CH4(g)+2NO2(g)=N2(g) +CO2(g)+2H2O(g);△H=-867kJmol-1
则CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g);△H=____________________
(2)利用氧化氮氧化物的流程如下:
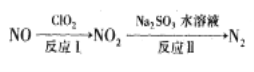
已知反应I的化学方程式为2NO+ClO2+H2O=NO2+HNO3+HCl,若反应I中转移3mol电子,则反应Ⅱ中可生成N2的体积为_____L(标准状况下)。
(3)常温下,用NaOH溶液吸收SO2得到pH=9的Na2SO3溶液,吸收过程中水的电离程度_____(填“增大”、“减小”或“不变”);请写出Na2SO3溶液中,c(Na+)、c(H2SO3)、c(SO32-)、c(HSO3-)的大小关系:_____。
(4)利用Fe2(SO4)3溶液也可处理SO2废气,所得Fe2+溶液有很多重要用途。保存1.8molL﹣1的FeSO4溶液时,为防止溶液中Fe2+被氧化,常加入_____;为确保溶液中不出现浑浊,应调节溶液的pH不超过_____。(常温下,Ksp[Fe(OH) 2]=1.8×10﹣16)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于0.1 mol·L-1 Na2SO3溶液,正确的是( )
A. c(H+) +c(HSO3-) +2c(H2SO3) =c(OH-)
B. c(Na+)=2c(SO32-)+c(HSO3-)+c(H2SO3)
C. c(Na+)+c(H+)=2c(SO32-)+2c(HSO3-)+c(OH-)
D. 升高温度,溶液pH降低
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com