
| 化合物 | 燃烧热 | 化合物 | 燃烧热 |
| 甲烷 | 891.0 | 正丁烷 | 2878.0 |
| 乙烷 | 1560.8 | 异丁烷 | 2869.6 |
| 丙烷 | 2221.5 | 2-甲基丁烷 | 3531.3 |
| A. | 稳定性:正丁烷>异丁烷 | |
| B. | 乙烷燃烧的热化学方程式为:2C2H6(g)+7O2(g)═4CO2(g)+6H2O(g)△H=-1560.8KJ/mol | |
| C. | 正戊烷的燃烧热大约在3540 KJ/mol左右 | |
| D. | 相同质量的烷烃,碳的质量分数越大,完全燃烧放出的热量越多 |
分析 A.物质具有的能量越低,越稳定;
B.乙烷的燃烧热为1560.8KJ/mol,说明完全燃烧1mol乙烷生成二氧化碳和液态水时会放出1560.8KJ的热量;
C.根据图表得出,正丁烷的燃烧热比异丁烷燃烧热高些,以此来分析正戊烷的燃烧热;
D.相同质量的烷烃,燃烧放热多少和氢的质量分数有关.
解答 解:A.由表格中的数据可知,异丁烷的燃烧热比正丁烷的燃烧热小,则异丁烷的能量低,即热稳定性为正丁烷<异丁烷,故A错误;
B.根据乙烷燃烧热的含义:完全燃烧1mol乙烷生成二氧化碳和液态水时会放出1560.8KJ的热量,所以热化学方程式为2C2H6(g)+7O2(g)=4CO2(g)+6H2O(l)△H=-3121.6kJ/mol,故B错误;
C.正戊烷和2-甲基丁烷互为同分异构体,由表格中正丁烷、异丁烷的燃烧热比较可知,则互为同分异构体的化合物,支链多的燃烧热小,则正戊烷的燃烧热大于2-甲基丁烷,即正戊烷的燃烧热大约在3540KJ/mol左右,且大于3531.3KJ/mol,故C正确;
D.相同质量的烷烃,氢的质量分数越大,燃烧放热越多,故D错误,
故选C.
点评 本题考查了燃烧热的概念及应用、能量与物质稳定性的关系以及学生对数据的分析处理能力等,为高频考点,侧重考查学生的分析能力,难度中等,C为易错点,注意分析互为同分异构体的燃烧热关系.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | 若管道漏气遇氨就会产生白烟 | B. | 该反应利用了Cl2的强氧化性 | ||
| C. | 生成1molN2有6mol电子转移 | D. | 该反应属于复分解反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:实验题
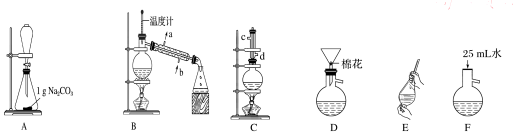
| 熔点/℃ | 沸点/℃ | 密度/g•cm-3 | 水溶性 | |
| 苯甲酸 | 122.4 | 249 | 1.27 | 微溶 |
| 甲醇 | -97 | 64.3 | 0.79 | 互溶 |
| 苯甲酸甲酯 | -12.3 | 199.6 | 1.09 | 不溶 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 31g白磷分子中含有P-P键个数为1.5×6.02×1023 | |
| B. | 48g O2和48g O3所含分子数相等 | |
| C. | 1mol/L氨水中,NH3•H2O的分子数为6.02×1023 | |
| D. | 20g重水(D2O)中含有的中子数为8×6.02×1023 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | Fe2+、I-、Cl-三种离子一定存在 | |
| B. | CO32-一定不存在,不能确定Na+和Cl-是否存在 | |
| C. | Fe3+与Fe2+至少有一种 | |
| D. | 该溶液中c(Cl-)至少为0.2mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Cl2常用于自来水消毒 | |
| B. | SO2常用于漂白食品 | |
| C. | 乙烯可以调节植物生长 | |
| D. | Na2O2可用于呼吸面具中氧气的来源 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在0.1mol•L-1氨水中加几滴酚酞,再加等体积的醋酸铵溶液,观察红色是否变浅 | |
| B. | 测定0.1 mol•L-1NH4C1溶液的酸碱性 | |
| C. | 测定0.lmol•L-1氨水的pH | |
| D. | 比较浓度均为0.1 mol•L -1的氨水与NaOH溶液的导电能力 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | OH-、K+、Cl- | B. | Ca2+、NO3-、CO32- | C. | Fe3+、Na+、OH- | D. | H+、HCO3-、SO42- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com