
【题目】工业上利用废镍催化剂(主要成分为Ni,还含有一定量的Zn、Fe、SiO2、CaO)制备草酸镍晶体(NiC2O4·2H2O)的流程如下:

(1)NiC2O4·2H2O中C的化合价是___。既能加快“酸浸”反应速率又能提高“酸浸”原料利用率的操作措施为___。
(2)“滤渣Ⅰ”的主要成分是___。
(3)在隔绝空气的条件下,高温煅烧无水NiC2O4得到Ni2O3和两种含碳元素的气体,该反应的化学方程式是___。
(4)高能锂离子电池的总反应为2Li+FeS=Fe+Li2S。用该电池作电源电解含镍酸性废水回收Ni的装置如图(图中X、Y为电极,LiPF6·SO(CH3)2为电解质)。

①电极X的反应材料是___(填化学式);中间隔室b可以得到的主要物质Z是___(填化学式)。
②电解总反应的离子方程式为___。
已知F=96500C/mol,若电池工作tmin,维持电流强度为I A,理论回收Ni___g(写出计算表达式即可)。
【答案】+3 废镍催化剂粉碎或适当加热、适当增大硫酸浓度、搅拌等 SiO2和CaSO4 2NiC2O4![]() Ni2O3+3CO↑+CO2↑ FeS NaCl 4OH-+2Ni2+
Ni2O3+3CO↑+CO2↑ FeS NaCl 4OH-+2Ni2+![]() O2↑+2Ni+2H2O
O2↑+2Ni+2H2O ![]()
【解析】
制备草酸镍晶体(NiC2O4·2H2O)的流程:废镍催化剂(主要成分为Ni,还含有一定量的Zn、Fe、SiO2、CaO)加入硫酸溶解得到含有Ni2+、Zn2+、Fe2+、Ca2+的酸性溶液,部分Ca2+与SO42-结合得到微溶物CaSO4,SiO2不溶于酸,过滤,滤渣I为SiO2和CaSO4,向滤液中加入NaClO溶液氧化Fe2+为Fe3+,同时将其沉淀为Fe(OH)3,过滤,滤渣II为Fe(OH)3,再向滤液中加入NH4F溶液,沉淀Ca2+为CaF2,滤渣III为CaF2,最后加入有机萃取剂萃取Zn2+,得到的水层主要为Ni2+,再向其中加入(NH4)2C2O4溶液,得到产品草酸镍晶体(NiC2O4·2H2O),高温煅烧无水NiC2O4的反应为:2NiC2O4![]() Ni2O3+3CO↑+CO2↑;
Ni2O3+3CO↑+CO2↑;
用高能锂离子电池作电源电解含镍酸性废水回收Ni:高能锂离子中,Li为电源负极,FeS为电源正极,电解池中连接电源负极的为阴极,发生还原反应,连接电源正极为阳极,发生氧化反应,据此分析作答。
(1)NiC2O4·2H2O中镍元素+2价,氧元素2价,化合物中元素化合价总共为0,则碳元素+3价;将废镍催化剂粉碎或适当加热、适当增大硫酸浓度、搅拌等能加快“酸浸”反应速率又能提高“酸浸”原料利用率,
故答案为:+3;废镍催化剂粉碎或适当加热、适当增大硫酸浓度、搅拌等;
(2)由上述分析可知,滤渣I为SiO2和CaSO4,
故答案为:SiO2和CaSO4;
(3)高温煅烧无水NiC2O4得到Ni2O3和两种含碳元素的气体,气体为一氧化碳和二氧化碳,故反应为:2NiC2O4![]() Ni2O3+3CO↑+CO2↑,
Ni2O3+3CO↑+CO2↑,
故答案为:2NiC2O4![]() Ni2O3+3CO↑+CO2↑;
Ni2O3+3CO↑+CO2↑;
(4)①因该电解池的目的是从含镍酸性废水回收Ni,因此c池中发生还原反应,故Y电极为电源负极,X为电源正极,由电池总反应可知,其电源正极的反应材料为FeS;该电解池工作时,c池中Ni2+被还原,Cl-通过阴离子交换膜进入b中,a池中OH-发生氧化反应生成水和氧气,Na+通过阳离子交换膜进入b池中,因此b池中得到的主要物质为NaCl,
故答案为:FeS;NaCl;
②由①分析可知,其电解池总反应为:4OH-+2Ni2+![]() O2↑+2Ni+2H2O;由题可知,tmin内转移电子
O2↑+2Ni+2H2O;由题可知,tmin内转移电子![]() mol,Ni2+被还原为Ni,每生成1molNi,转移电子为2mol,因此可回收Ni的质量为
mol,Ni2+被还原为Ni,每生成1molNi,转移电子为2mol,因此可回收Ni的质量为![]() g,
g,
故答案为:4OH-+2Ni2+![]() O2↑+2Ni+2H2O;
O2↑+2Ni+2H2O;![]() 。
。


科目:高中化学 来源: 题型:
【题目】硫化镉(CdS)是一种难溶于水的黄色颜料,其在水中的沉淀溶解平衡曲线如图所示。下列说法不正确的是( )

A.图中a和b分别为T1、T2温度下CdS在水中的溶解度
B.图中各点对应的Ksp的关系为:Ksp(m)=Ksp(n)<Ksp(p)<Ksp(q)
C.向n点的溶液中加入少量CdCl2固体,溶液组成由n沿npm线向m方向移动
D.温度升高时,p点的饱和溶液的组成由p沿pq线向q方向移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种形状像蝴蝶结的有机分子Bowtiediene,其形状和结构如图所示,下列有关该分子的说法中错误的是

A. 生成1 mol C5 H12至少需要4 mol H2
B. 该分子中所有碳原子在同一平面内
C. 三氯代物只有一种
D. 与其互为同分异构体,且只含碳碳三键的链烃有两种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知Ksp(BaSO4)= 1.1×10-10,Ksp(BaCO3)=2.5×10-9。下列说法中不正确的是
A.BaSO4比BaCO3溶解度小,所以,BaCO3可以转化为BaSO4
B.BaCO3、BaSO4均不溶于水,所以都可以做钡餐试剂
C.向Na2CO3溶液中加入BaCl2和Na2SO4,当两种沉淀共存时,c(SO42-)/ c(CO32-) =4.4×10-2
D.常温下,BaCO3若要在Na2SO4溶液中开始转化为BaSO4,则Na2SO4的浓度必须不低于2.2×10-6mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将MnO2与FeSO4溶液、硫酸充分反应后过滤,将滤液加热至60℃后,再加入Na2CO3溶液,最终可制得碱式碳酸锰[aMnCO3·bMn(OH)2·cH2O]。
(1)用废铁屑与硫酸反应制备FeSO4溶液时,所用铁屑需比理论值略高,原因是 ,反应前需将废铁屑用热Na2CO3溶液浸泡,其目的是 。
(2)为测定碱式碳酸锰组成,取7.390 g样品溶于硫酸,生成CO2 224.0 mL(标准状况),并配成500 mL溶液。准确量取10.00 mL该溶液,用0.0500 mol·L-1 EDTA(化学式Na2H2Y)标准溶液滴定其中的Mn2+(原理为Mn2+ +H2Y2-=MnY2-+2H+),至终点时消耗EDTA标准溶液28.00 mL。通过计算确定该样品的化学式。(写出计算过程)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】含硫煤燃烧会产生大气污染物,为防治该污染,某工厂设计了新的治污方法,同时可得到化工产品,该工艺流程如图所示,下列叙述不正确的是( )

A.该过程中可得到化工产品H2SO4
B.该工艺流程是除去煤燃烧时产生的SO2
C.该过程中化合价发生改变的元素只有Fe和S
D.图中涉及的反应之一为Fe2(SO4)3+SO2+2H2O=2FeSO4+2H2SO4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E是原子序数依次增大的五种短周期主族元素,其中A的原子序数是B和D原子序数之和的1/4,C元素的最高价氧化物的水化物是一种中强碱,甲和丙是D元素的两种常见氧化物,乙和丁是B元素的两种常见同素异形体,0.005mol/L戊溶液的pH=2,它们之间的转化关系如图所示(部分反应物省略),下列叙述正确的是
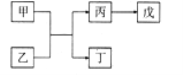
A. C、D两元素形成化合物属共价化合物
B. C和E形成的化合物的水溶液呈碱性
C. 简单离子半径D > B > C
D. E的氧化物水化物的酸性大于D的氧化物水化物的酸性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】把NaOH、MgCl2、AlCl3三种固体组成的混合物溶于足量水后有1.16 g白色沉淀,在所得的悬浊液中逐滴加入1 mol·L-1 HCl溶液,加入HCl溶液的体积V与生成沉淀的质量m的关系如图所示,试回答:

(1)A点→B点反应的离子方程式为_______________________。
(2)原混合物中AlCl3的物质的量为______,NaOH的物质的量为_____。
(3)C点加入的HCl溶液体积为_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以海水为电解质的Mg-AgCl电池在军事上可用作电动鱼雷的电源,其电池反应离子方程式为:2AgCl+Mg=Mg2++2Ag+2Cl-。该电池工作时,下列说法正确的是( )

A.正、负极的质量均减少
B.电子由AgCl经外电路流向Mg
C.AgCl电极发生氧化反应
D.该装置实现了电能向化学能的转化
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com