
分析 ①根据H+(aq)+OH-(aq)═H2O(l)△H=-57.3kJ•mol-1可知,生成1molH2O放出热量为57.3kJ,然后根据水的物质的量与热量成正比求出热量即可;
②根据热化学方程式判断红磷和白磷能量的高低,能量越低,物质越稳定.
解答 解:①H+(aq)+OH-(aq)═H2O(l)△H=-57.3kJ•mol-1可知,生成1molH2O放出热量为57.3kJ,
80gNaOH即2mol氢氧化钠配成稀溶液后,氢氧根离子的浓度是2mol,和足量的酸之间反应会生成2mol水,所以放出热量为2×57.3kJ=114.6kJ,
故答案为:114.6;
②根据热化学方程式P4(白磷,s)=4P(红磷,s);△H=-29.24kJ/mol可知,红磷的能量比白磷低,所以红磷比白磷稳定,
故答案为:红磷.
点评 本题考查中和热的计算及对物质的稳定性比较,注意热化学方程式中,反应热和方程式的系数成正比,注意把握中和热概念:应是稀溶液,生成水为1mol,发生反应的本质是氢离子与氢氧根反应生成水,注意理解弱电解质、浓溶液对中和热的影响.题目难度不大.


 特高级教师点拨系列答案
特高级教师点拨系列答案科目:高中化学 来源: 题型:选择题
| 实验 | 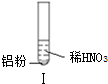 | 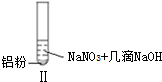 | 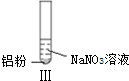 |
| 现象 | 溶液无色,试管上方 呈红棕色 | 产生大量气泡,能使湿润红 色石蕊试纸变蓝 | 产生气泡,能使湿润红色石蕊试纸变蓝 |
| A. | 实验Ⅰ试管上方呈现红棕色的原因是:2NO+O2=2NO2 | |
| B. | 根据实验Ⅱ、Ⅲ的气体检验结果,说明都有NH3产生 | |
| C. | 实验Ⅰ溶液中发生的反应是:Al+6H++3NO3-=Al3++3NO2↑+3H2O | |
| D. | 在实验Ⅰ、Ⅱ、Ⅲ中,NO3-在酸、碱及中性溶液中都被还原 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 物质的量浓度相等的①NH4Cl ②(NH4)2SO4 ③NH4Al(SO4)2三种溶液中,c(NH4+由大到小的顺序为:③>②>① | |
| B. | 0.1mol•L-1CH3COOH与0.05mol•L-1NaOH溶液等体积混合(pH<7): c(CH3COO-)>c(Na+)>cCH3COOH)>c(H+) | |
| C. | 0.1 mol•L-1Na2CO3与0.05mol•L-1 NaHCO3溶液等体积混合: $\frac{3}{5}$c(Na+)=c(CO32-)+c(HCO3-)+c(H2CO3) | |
| D. | 在0.1 mol•L-1NaHC2O4溶液(pH<7)中:c(OH-)+2c(C2O42-)=c(H+)+2c(H2C2O4) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用稀硫酸除钢铁表面的铁锈利用了硫酸的酸性 | |
| B. | 干冰用于人工降雨,是利用了干冰升华吸热 | |
| C. | 胃药中含氢氧化镁是因为氢氧化镁能给人提供镁元素 | |
| D. | 碳酸氢钠作焙制糕点的发酵粉是利用了碳酸氢钠能与发醇面团中的酸性物质反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
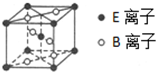 A、B、C、D、E为核电荷数依次增大的五种元素.A的基态原子中有2个未成对电子,B是地壳中含量最多的元素,C是短周期中最活泼的金属元素,D与C可形成CD型离子化合物,E的基态原子3d轨道上有2个电子.请回答下列问题:
A、B、C、D、E为核电荷数依次增大的五种元素.A的基态原子中有2个未成对电子,B是地壳中含量最多的元素,C是短周期中最活泼的金属元素,D与C可形成CD型离子化合物,E的基态原子3d轨道上有2个电子.请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 8.0gCuO和Cu2S的混合物含铜原子个数为0.2NA | |
| B. | 标准状况下,11.2L乙醇蒸气含共价键数目为4NA | |
| C. | 1molK与O2完全反应生成K2O、K2O2、KO3的混合物,转移电子数为NA | |
| D. | 1L0.2mol•L-1NH4ClO4溶液中含NH4+数目为0.2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 亚硫酸钠 | B. | 溴化铁 | C. | 锌粉 | D. | 铁粉 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 第一句 | B. | 第二句 | C. | 第三句 | D. | 第四句 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com