
 愉快的寒假南京出版社系列答案
愉快的寒假南京出版社系列答案科目:高中化学 来源: 题型:
硒(Se)与硫在元素周期表中位于同一主族。下列说法不正确的是
A.原子半径:Se > S B.沸点:H2S > H2Se
C.稳定性:H2S > H2Se D.酸性:H2SO4 > H2SeO4
查看答案和解析>>
科目:高中化学 来源: 题型:
下列关于工业生产的说法正确的是
A.在侯氏制碱工业中,向饱和氯化钠溶液中先通二氧化碳,后通氨气
B.在硫酸工业、合成氨工业、硝酸工业中,皆采用循环操作提高原料利用率
C.在氯碱工业,电解槽一般用铁网作电极
D.合成氨工业用天然气造气的方法中,与水蒸汽高温反应优于热分解法
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法错误的是
A、主族元素的最外层电子数都等于它的最高正化合价
B、同一主族的元素的原子最外层电子数相等
C、同周期的主族元素随核电荷数的递增原子半径逐渐减小
D、第N周期有N种主族元素是金属元素(N>1)
查看答案和解析>>
科目:高中化学 来源: 题型:
下表是周期表的一部分,根据A~I在周期表中的位置,用元素符号或化学式回答问题:
| 族周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 1 | A | |||||||
| 2 | D | E | G | |||||
| 3 | B | C | J | F | H | I |
(1)表中元素,化学性质最不活泼的是 _________ ,只有负价而无正价的是 _________ ,可用于制半导体材料的元素是 _________ .
(2)最高价氧化物的水化物碱性最强的物质的电子式是 _________ ,酸性最强的物质是 _________ ,呈两性的物质是 _________ ;
(3)A分别与D、E、F、G、H形成的化合物中,最稳定的化合物是 _________ ;
(4)B元素与A形成的化合物和水反应后溶液呈碱性,同时生成一种可燃气体,写出反应的化学方程式 _________ .
查看答案和解析>>
科目:高中化学 来源: 题型:
下列有关σ键和π键的说法错误的是 ( )。
A.在某些分子中,化学键可能只有π键而没有σ键
B.当原子形成分子时,首先形成σ键,可能形成π键,配位键都是σ键
C.σ键的特征是轴对称,π键的特征是镜面对称
D.含有π键的分子在反应时,π键是化学反应的积极参与者
查看答案和解析>>
科目:高中化学 来源: 题型:
草酸钴用途广泛,可用于指示剂和催化剂制备。一种利用水钴矿[主要成分为Co2O3,含少量Fe2O3、Al2O3、MnO、MgO、CaO等]制取CoC2O4·2H2O工艺流程如下:
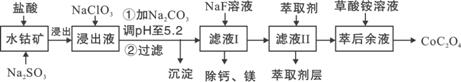 |
已知:①浸出液含有的阳离子主要有H+、Co2+、Fe2+、Mn2+、Ca2+、Mg2+、Al3+等;
②部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Co(OH)2 | Al(OH)3 | Mn(OH)2 |
| 完全沉淀的pH | 3.7 | 9.6 | 9.2 | 5.2 | 9.8 |
(1)浸出过程中加入Na2SO3的目的是将_____________还原(填离子符号)。
(2)NaClO3的作用是将浸出液中的Fe2+氧化成Fe3+,产物中氯元素处于最低化合价。该反应的离子方程式为____________。
 (3)请用平衡移动原理分析加Na2CO3能使浸出液中Fe3+、Al3+转化成氢氧化物沉淀的原因:____________________。
(3)请用平衡移动原理分析加Na2CO3能使浸出液中Fe3+、Al3+转化成氢氧化物沉淀的原因:____________________。
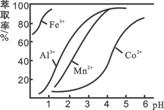
(4)萃取剂对金属离子的萃取率与pH的关系如图所示。
滤液Ⅱ中加入萃取剂的作用是_________;使用萃取
剂适宜的pH是______。
A.接近2.0 B.接近3.0 C.接近4.0
(5)“除钙、镁”是将溶液中Ca2+与Mg2+转化为MgF2、CaF2沉淀。已知Ksp(MgF2)=7.35×10-11、Ksp(CaF2)=1.05×10-10。当加入过量NaF后,所得滤液c(Mg2+)/ c (Ca2+)=____。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com