
| A. | 可用聚氯乙烯代替乙烯制作食品包装袋 | |
| B. | 去除银器表面Ag2S,可将银器放在盛有食醋的铝锅中煮沸片刻 | |
| C. | 开发核能、太阳能等新能源,推广甲醇汽油,使用无磷洗涤剂都符合环保理念 | |
| D. | “连续纤维增韧”航空材料主要是由碳化硅、陶瓷和碳纤维复合而成,是一种新型无机非金属材料 |
分析 A.聚氯乙烯使用时排放有毒的物质;
B.Ag2S和Al在醋酸溶液中发生反应生成银、醋酸铝和硫化氢;
C.开发核能、太阳能等新能源,推广甲醇汽油,能减少大气污染物的排放,使用无磷洗涤剂,能避免水体的富营养化;
D.碳化硅陶瓷和碳纤维由非金属元素组成.
解答 解:A.聚氯乙烯使用时排放有毒的物质,不能用聚氯乙烯制作食品包装袋薄膜,故A错误;
B.Ag2S和Al在醋酸溶液中发生反应生成银、醋酸铝和硫化氢,故B正确;
C.开发核能、太阳能等新能源,推广甲醇汽油,能减少大气污染物的排放,使用无磷洗涤剂,能避免水体的富营养化,符合环保理念,故C正确;
D.碳化硅陶瓷和碳纤维由非金属元素组成,为新型无机非金属材料,故D正确;
故选:A.
点评 本题考查较为综合,涉及化学与生活、生产、环境的考查,为高频考点,侧重于基础知识的综合理解和运用的考查,注意相关基础知识的积累,难度不大.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:解答题
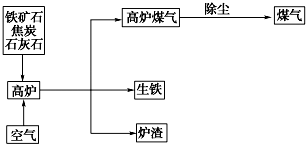
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
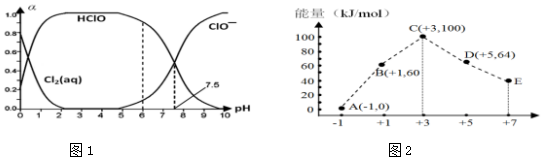
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
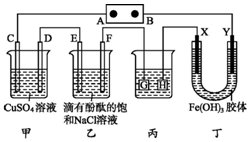 如图装置所示,C、D、E、F、X、Y都是惰性电极,甲、乙中溶液的体积和浓度都相同(假设通电前后溶液体积不变),A、B为外接直流电源的两极.将直流电源接通后,F极附近呈红色.
如图装置所示,C、D、E、F、X、Y都是惰性电极,甲、乙中溶液的体积和浓度都相同(假设通电前后溶液体积不变),A、B为外接直流电源的两极.将直流电源接通后,F极附近呈红色.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验目的 | 方案 |
| A | 除去乙酸乙酯中的乙酸 | 用NaOH溶液洗涤,分液,然后干燥 |
| B | 除去葡萄糖溶液中的乙醇 | 用KMnO4氧化,再蒸馏 |
| C | 检验食盐中是否添加KIO3 | 食盐溶解,然后加入淀粉溶液 |
| D | 测定醋酸溶液浓度 | 酚酞作指示剂,用标准NaOH溶液滴定 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 绿矾一FeSO4•7H2O | B. | 芒硝一Na2SO4•10H2O | ||
| C. | 明矾一Al(SO4)3•12H2O | D. | 胆矾一CuSO4•5H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
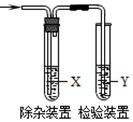 用如图所示装置检验乙烯时不需要除杂的是( )
用如图所示装置检验乙烯时不需要除杂的是( )| 乙烯的制备 | 试剂X | 试剂Y | |
| A | CH3CH2Br与NaOH乙醇溶液共热 | 水 | KMnO4酸性溶液 |
| B | CH3CH2Br与NaOH乙醇溶液共热 | 水 | Br2的CCl4溶液 |
| C | C2H5OH与浓H2SO4加热至170℃ | NaOH溶液 | KMnO4酸性溶液 |
| D | C2H5OH与浓H2SO4加热至170℃ | NaOH溶液 | Br2的CCl4溶液 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
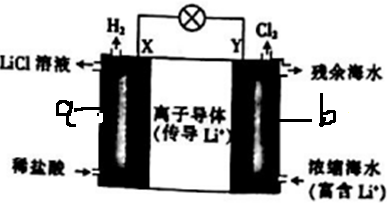
| A. | 电池工作时,Li+通过离子导体移向b区 | |
| B. | 电流由X极通过电路移向Y极 | |
| C. | 正极发生的反应为2H++2e-═H2↑ | |
| D. | Y极每生成1molCl2,a区得到2molLiCl |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com