
【题目】锌锰干电池为使用一次后就被废弃的电池,因含有汞、酸或碱等,废弃后进入环境将造成严重危害。某化学兴趣小组拟采用如下处理方法回收废电池中的各种资源。
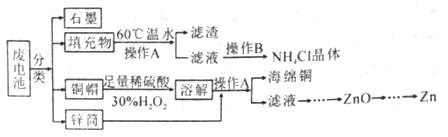
(1)用60℃温水溶解填充物,目的是________。
(2)操作B的名称为_____________。
(3)铜帽溶解的化学方程式为__________;铜帽溶解完全后,可采用_____方法除去溶液中过量的H2O2。
(4)填充物中含有MnOOH、MnO2等化合物,向滤渣中加入一定量的稀草酸和l0mL稀硫酸,得到MnSO4溶液并收集到896mLCO2(标准状况下),所用稀硫酸的物质的量浓度是_________。
(5)向一定量水样中加入适量MnSO4溶液和碱性KI溶液,生成MnO(OH)2沉淀,密封静置,加入适量稀H2SO4,待MnO(OH)2与I-完全反应生成Mn2+和I2后,以淀粉作指示剂,用Na2S2O3标准溶液滴定至终点,运用此方法可以测定水中溶解氧的浓度。测定过程中物质的转化关系如下:
![]()
取一定量的池塘水样l00.00mL,按上述方法测定水样的溶解氧,消耗0.0100molL-1 Na2S2O3标准溶液13.50mL,该水样中的溶解氧的浓度为____mgL-1。
【答案】 加大溶解速率,同时防止温度过高氯化铵分解 结晶 Cu+H2O2+H2SO4=CuSO4+2H2O 加热 3.0mol/L 10.80mg/L
【解析】废旧干电池含有铜、石墨、二氧化锰以及填充物等,填充物用60℃充分溶解,过滤,滤液中含有氯化铵,蒸发、浓缩、结晶可得到氯化铵晶体;铜与稀硫酸在过氧化氢作用发生氧化还原反应生成硫酸铜,加入锌可置换出铜,过滤分离,硫酸锌溶液最终可生成氢氧化锌、氧化锌,冶炼可得到锌。(1)加热,适当升高温度,可促进溶解,故答案为:加大溶解速率,同时防止温度过高氯化铵分解;(2)滤液中含有氯化铵,蒸发、浓缩、结晶可得到氯化铵晶体,所以该操作名称是结晶;(2)酸性条件下,双氧水能将铜氧化,铜帽溶解反应生成铜离子,反应的化学方程式为:Cu+H2O2+H2SO4=CuSO4+2H2O;加热条件下,双氧水易分解生成水和氧气,所以除去双氧水的方法是加热;(4)滤渣的主要成分为含锰混合物,向含锰混合物中加入一定量的稀硫酸、稀草酸,并不断搅拌至无气泡为止。其主要反应为2 MnO(OH)+MnO2+2H2C2O4+3H2SO4═3MnSO4+4CO2↑+6H2O,根据反应方程式可知,硫酸的物质的量为:![]() ×
×![]() =0.03mol,c=
=0.03mol,c=![]() =
=![]() =3.0mol/L;(5)根据转化关系:O2-MnO(OH)2-I2-Na2S4O6;在100.00mL水样中,存在I2+2S2O32-=2I-+S4O62-;n(I2)=
=3.0mol/L;(5)根据转化关系:O2-MnO(OH)2-I2-Na2S4O6;在100.00mL水样中,存在I2+2S2O32-=2I-+S4O62-;n(I2)=![]() =
=![]() =6.750×10-5mol,根据题中MnO(OH)2与I-完全反应生成Mn2+和I2,可知发生了氧化还原反应,根据电子得失守恒:n[MnO(OH)2]=n(I2)= 6.750×10-5mol;n(O2)=
=6.750×10-5mol,根据题中MnO(OH)2与I-完全反应生成Mn2+和I2,可知发生了氧化还原反应,根据电子得失守恒:n[MnO(OH)2]=n(I2)= 6.750×10-5mol;n(O2)=![]() n[MnO(OH)2]=
n[MnO(OH)2]=![]() ×6.750×10-5mol=3.375×10-5mol,水中溶解氧=
×6.750×10-5mol=3.375×10-5mol,水中溶解氧=![]() =10.80mg/L。
=10.80mg/L。


 超能学典应用题题卡系列答案
超能学典应用题题卡系列答案科目:高中化学 来源: 题型:
【题目】海带中含有丰富的碘.为了从海带中提取碘,某研究性学习小组设计并进行了以下实验: 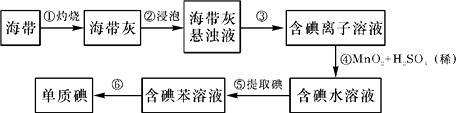
请填写下列空白:
(1)步骤①灼烧海带时,除需要三脚架外,还需要用到的实验仪器是(从下列仪器中选出所需的仪器,用标号字母填写在空白处).
A.烧杯
B.坩埚
C.表面皿
D.泥三角
E.酒精灯
F.干燥器
(2)步骤③的实验操作名称是;步骤⑥的目的是从含碘苯溶液中分离出单质碘和回收苯,该步骤的实验操作名称是 .
(3)步骤④反应的离子方程式是 .
(4)步骤⑤中,某学生选择用苯来提取碘的理由是 .
(5)请设计一种检验提取碘后的水溶液中是否还含有单质碘的简单方法 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定量的盐酸跟过量的铁粉反应时,为了减缓反应速率,且不影响生成氢气的总量,可向盐酸中加入适量的
A.NaOH(固体) B.KNO3
C.HCl D.CH3COONa(固体)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Hg可用KMnO4溶液吸收。在不同pH下,KMnO4溶液对Hg的吸收率及主要产物如下图所示。下列有关说法不正确的是
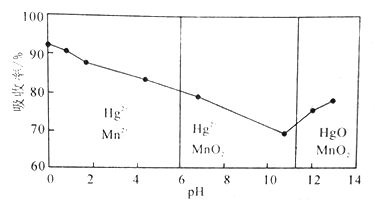
A. pH对Hg吸收率的影响规律是随pH升高Hg的吸收率先降低后升高
B. pH=l时Hg的吸收率高达90%的原因是KMnO4在酸性条件下氧化性强
C. pH = 2时反应的离子方程式为Hg+MnO4-+8H+=Hg2++Mn2++4H2O
D. pH = 12时反应的离子方程式为3Hg+2MnO4-+ H2O=3HgO+2MnO2+2OH-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】把7.4g Na2CO310H2O和NaHCO3组成的混合物溶于水配成100mL溶液,测得溶液中钠离浓度为0.6mol/L.若把等质量的混合物加热至恒重,残留物的质量是( )
A.3.18 g
B.2.12 g
C.4.22 g
D.5.28 g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃、101 kPa下,2g氢气燃烧生成液态水,放出285.8kJ热量,表示该反应的热化学方程式正确的是( )
A. 2H2(g)+O2(g) == 2H2O(1) △H= ―285.8kJ/mol![]()
B. 2H2(g)+ O2(g) == 2H2O(1) △H= +571.6 kJ/mol
C. 2H2(g)+O2(g) == 2H2O(g) △H= ―571.6 kJ/mol
D. H2(g)+1/2O2(g) == H2O(1) △H= ―285.8kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A,B,C,D,E,在一定条件下的转换条件如图所示. 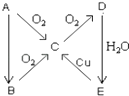
(1)若A常温下为固态单质,C为能使品红溶液褪色的气体,则
C→D变化的化学方程式为 ,
E→C变化的化学方程式为 .
(2)若A常温下为气态单质,则A为;D为;A→B变化的化学方程式为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】可逆反应N2+3H2![]() 2NH3是一个放热反应。有甲、乙两个完全相同的容器,向甲容器中加入1molN2和3molH2,在一定条件下,达平衡时放出的热量为Q1;在相同条件下,向乙容器加入2molNH3,达平衡时,吸收的热量为Q2.已知Q2=4Q1,则甲容器中H2的转化率为
2NH3是一个放热反应。有甲、乙两个完全相同的容器,向甲容器中加入1molN2和3molH2,在一定条件下,达平衡时放出的热量为Q1;在相同条件下,向乙容器加入2molNH3,达平衡时,吸收的热量为Q2.已知Q2=4Q1,则甲容器中H2的转化率为
A. 80% B. 25% C. 75% D. 20%
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com