
| A. | Cl2常用于自来水消毒 | |
| B. | SO2常用于漂白食品 | |
| C. | 乙烯可以调节植物生长 | |
| D. | Na2O2可用于呼吸面具中氧气的来源 |
分析 A.氯气可与水反应生成具有杀菌消毒能力的HClO;
B.二氧化硫对人体有害;
C.乙烯为植物生长的催熟剂;
D.过氧化钠可与水、二氧化碳反应生成氧气.
解答 解:A.氯气可与水反应生成具有杀菌消毒能力的HClO,可用于自来水的消毒,故A正确;
B.二氧化硫对人体有害,不能用于漂白食品,故B错误;
C.乙烯为植物生长的催熟剂,可用于调节植物的生长,故C正确;
D.过氧化钠可与水、二氧化碳反应生成氧气,可用于呼吸面具中氧气的来源,故D正确.
故选B.
点评 本题考查物质的性质和用途,为高频考点,侧重于化学与生活、生产的考查,有利于培养学生良好的科学素养,题目难度不大,建议学习中注重相关基础知识的积累.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:选择题
| A. | 铁与氯化铁溶液反应:Fe+Fe3+═2Fe2+ | |
| B. | 氢氧化铜溶液与硫酸反应:OH-+H+═H2O | |
| C. | 二氧化硅与氢氧化钠溶液反应:SiO2+2OH-═H2SiO3 | |
| D. | 碳酸钙与醋酸反应:CaCO3+2CH3COOH═Ca2++2CH3COO-+CO2↑+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
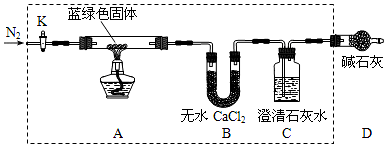
| 溶解度(S)/g | 溶度积(Ksp) | 摩尔质量(M)/g•mol-1 | |||
| Ca(OH)2 | Ba(OH)2 | CaCO3 | BaCO3 | CaCO3 | BaCO3 |
| 0.16 | 3.89 | 2.9×10-9 | 2.6×10-9 | 100 | 197 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 化合物 | 燃烧热 | 化合物 | 燃烧热 |
| 甲烷 | 891.0 | 正丁烷 | 2878.0 |
| 乙烷 | 1560.8 | 异丁烷 | 2869.6 |
| 丙烷 | 2221.5 | 2-甲基丁烷 | 3531.3 |
| A. | 稳定性:正丁烷>异丁烷 | |
| B. | 乙烷燃烧的热化学方程式为:2C2H6(g)+7O2(g)═4CO2(g)+6H2O(g)△H=-1560.8KJ/mol | |
| C. | 正戊烷的燃烧热大约在3540 KJ/mol左右 | |
| D. | 相同质量的烷烃,碳的质量分数越大,完全燃烧放出的热量越多 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
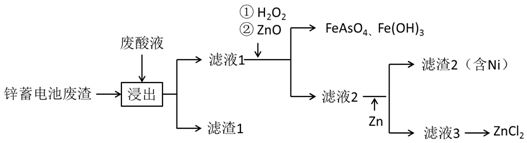
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
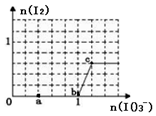 已知溶液中:还原性HSO3->I-,氧化性IO3->I2>SO42-.在含3molNaHSO3的溶液中逐滴加入KIO3溶液,加入的KIO3和析出的I2的物质的量的关系曲线如图所示.下列说法不正确的是( )
已知溶液中:还原性HSO3->I-,氧化性IO3->I2>SO42-.在含3molNaHSO3的溶液中逐滴加入KIO3溶液,加入的KIO3和析出的I2的物质的量的关系曲线如图所示.下列说法不正确的是( )| A. | a点反应的离子方程式为 IO3-+3HSO3-=I-+3SO42-+3H+ | |
| B. | b点到c点反应的离子方程式为 IO3-+5I-+6H+=3I2+3H2O | |
| C. | 当溶液中的I-为0.4 mol时,加入的KIO3只能为0.4 mol | |
| D. | 若往100 mL 1mol/L的KIO3溶液中逐滴滴加NaHSO3溶液,反应开始时的离子方程式为 2IO3-+5HSO3-=I2+5SO42-+H2O+3H+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NH4+、NO3-、Cl-、Na+ | B. | MnO4-、Ca2+、NO3-、Cl- | ||
| C. | HSO3-、HCO3-、NO3-、SO32- | D. | Na+、Ca2+、NO3-、CH3COO- |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
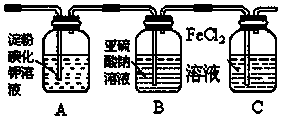
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Fe 2+、CH 3COOˉ、SO 42ˉ、Na + | B. | Ca 2+、K +、Cl-、HCO 3- | ||
| C. | NH 4+、Al 3+、NO 3-、Cl- | D. | K +、Na +、SO 32-、AlO 2- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com