
分析 (1)根据m=nM计算硫酸的质量,最高价N=nNA计算出含有氢原子数目;
(2)根据n=$\frac{N}{{N}_{A}}$计算氨气的物质的量,然后结合氨气分子组成计算出含有氢原子的物质的量;
(3)根据n=$\frac{V}{{V}_{m}}$计算出二氧化碳的物质的量.
解答 解:(1)1.5molH2SO4的质量是:98g/mol×1.5mol=147g,1mol硫酸分子中含有氢原子的物质的量为:1.5mol×2=3mol,
故答案为:147g;3;
(2)9.03×1023个NH3分子的物质的量为:$\frac{9.03×1{0}^{23}}{6.02×1{0}^{23}mo{l}^{-1}}$=1.5mol,1.5mol氨气分子中含有H的物质的量为:1.5mol×3=4.5mol,
故答案为:1.5;4.5;
(3)在标准状况下,3360mL的CO2的物质的量是:$\frac{3.36L}{22.4L/mol}$=0.15mol,
故答案为:0.15mol.
点评 本题考查物质的量的计算,题目难度中等,明确物质的量与其它物理量之间的关系为解答关键,试题培养了学生的分析能力及化学计算能力.


科目:高中化学 来源: 题型:选择题
| A. | 常温下,Na2O2与N2和CO2组成的混合气体反应生成0.5mol O2时,转移电子数是2NA | |
| B. | 标准状况下,11.2 L的甲醇所含的氢原子数等于2NA | |
| C. | 电解饱和食盐水,阳极产生22.4 L气体时,电路中通过的电子数目为2NA | |
| D. | 1L 1 mol/L CuCl2溶液中含有的氯离子数为2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
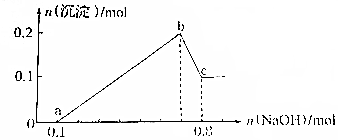 某溶液中可能含有H+、Mg2+、Al3+、Fe3+、Na+等阳离子中的一种或几种,当向该溶液中加入NaOH溶液时,产生沉淀的物质的量与所加NaOH物质的量之间的关系如图所示
某溶液中可能含有H+、Mg2+、Al3+、Fe3+、Na+等阳离子中的一种或几种,当向该溶液中加入NaOH溶液时,产生沉淀的物质的量与所加NaOH物质的量之间的关系如图所示查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 | 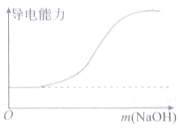 |
| A.向100mL 0.1mol•L-1H2SO4溶液中滴加 0.1mol•L-1Ba(OH)2溶液至过量 | B.向100mL 0.1mol•L-1H2SO4溶液中加入NaOH固体 |
 |  |
| C.向一定浓度的氯化钠溶液中加水 | D.向蒸馏水中通入HCl气体 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将废旧电池集中深埋,防止重金属污染 | |
| B. | 改善能源结构,大力发展太阳能、风能等清洁能源 | |
| C. | 推广碳捕集和转化成化工原料技术,逐步实现二氧化碳零排放 | |
| D. | 采用纳米TiO2光触媒技术,将装修材料中释放的HCHO转化为无害物质 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 大力发展电动车,减少燃油汽车的尾气排放量 | |
| B. | 开发利用各种新能源,减少对化石燃料的依赖 | |
| C. | PM2.5含有的铅、镉、铬、钒、砷等对人体有害的元素均是金属元素 | |
| D. | 多环芳烃是强致癌物,能吸附在PM2.5的表面进入人体 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
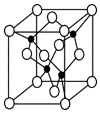 X、Y、Z、U、W 是原子序数依次增大的前四周期元素.其中 Y 的原子核外有 7 种运动状态不同的 电子;X、Z 中未成对电子数均为 2;U 是第三周期元素形成的简单离子中半径最小的元素;W 的内层电 子全充满,最外层只有 1 个电子.请回答下列问题:
X、Y、Z、U、W 是原子序数依次增大的前四周期元素.其中 Y 的原子核外有 7 种运动状态不同的 电子;X、Z 中未成对电子数均为 2;U 是第三周期元素形成的简单离子中半径最小的元素;W 的内层电 子全充满,最外层只有 1 个电子.请回答下列问题: .
.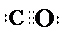 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
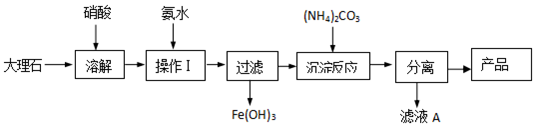
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com