
| 物质 | 熔点/℃ | 沸点/℃ | 密度/(g/cm3) |
| 乙醇 | -144 | 78 | 0.789 |
| 乙酸 | 16.6 | 117.9 | 1.05 |
| 乙酸乙酯 | -83.6 | 77.5 | 0.90 |
| 浓硫酸 | —— | 338 | 1.84 |




 新课标阶梯阅读训练系列答案
新课标阶梯阅读训练系列答案科目:高中化学 来源:不详 题型:单选题
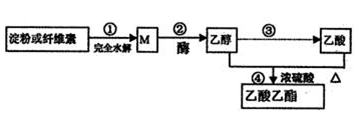
| A.常温下,M能与银氨溶液发生反应 |
| B.④的反应类型属于酯化反应,不属于取代反应 |
| C.用饱和碳酸钾溶液能鉴别乙醇、乙酸和乙酸乙酯. |
| D.淀粉和纤维素的化学式均为(C6H10O5)n,二者互为同分异构体 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
| | 乙酸 | 1-丁醇 | 乙酸丁酯 |
| 熔点/℃ | 16.6 | -89.5 | -73.5 |
| 沸点/℃ | 117.9 | 117 | 126.3 |
| 密度/g·cm-3 | 1.05 | 0.81 | 0.88 |
| 水溶性 | 互溶 | 互溶 | 不溶 |
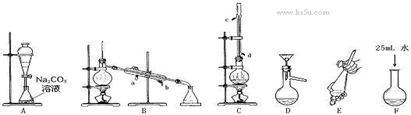
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.8 种 | B.14种 | C.16种 | D.18种 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.产品中含有被蒸馏出的H2SO4 | B.产品中含有未反应的乙醇 |
| C.产品中含有未反应的乙酸 | D.乙酸乙酯与Na2CO3溶液反应生成CO2 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
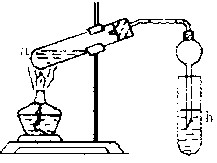
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.HOCH2CHO | B.HOCH2CH2OH |
| C.HOCH2COOH | D.CH3CH(OH)CH(OH)CH3 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
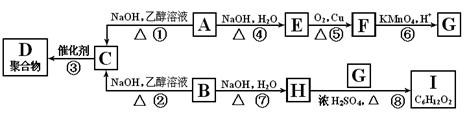
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com