
| A. | 制作印刷电路板:Fe3++Cu═Fe2++Cu2+ | |
| B. | 用石墨棒作电极电解CuCl2溶液:Cu2++2Cl-$\frac{\underline{\;通电\;}}{\;}$ Cu+Cl2↑ | |
| C. | 硫酸铝溶液与过量氢氧化钠溶液反应的离子方程式:Al3++3OH-═Al(OH)3↓ | |
| D. | 用醋酸巧除水垢的反应:CaC03+2H+═Ca2++C02↑+H20 |
分析 A.离子方程式两边正电荷不相等,违反了电荷守恒;
B.惰性电极电解氯化铜溶液,阳极氯离子放电生成氯气,阴极铜离子放电生成铜;
C.氢氧化钠过量,反应生成偏铝酸钠,不会生成氢氧化铝沉淀;
D.醋酸为弱酸,离子方程式中醋酸不能拆开.
解答 解:A.制作印刷电路板,铁离子与铜反应生成亚铁离子和铜离子,正确的离子方程式为:2Fe3++Cu═2Fe2++Cu2+,故A错误;
B.用石墨棒作电极电解CuCl2溶液,反应的离子方程式为:Cu2++2Cl-$\frac{\underline{\;通电\;}}{\;}$ Cu+Cl2↑,故B正确;
C.硫酸铝溶液与过量氢氧化钠溶液,反应生成偏铝酸钠和水,正确的离子方程式为:Al3++4OH-═AlO2-+2H2O,故C错误;
D.碳酸钙和醋酸都不能拆开,正确的离子方程式为:CaCO3+2CH3COOH=Ca2++H2O+CO2↑+2CH3COO-,故D错误;
故选B.
点评 本题考查了离子方程的书写,题目难度中等,为高考中的高频题,属于中等难度的试题,侧重对学生能力的培养和训练,注意掌握离子方程式的书写原则.


 小学教材全测系列答案
小学教材全测系列答案科目:高中化学 来源: 题型:解答题
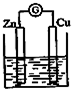 X,Y,Z,W为按原子序数由小到大排列的四种短周期的元素,X的阳离子为质子,Y原子有3个能级,各能级电子数相等,Z,W位于同一周期,Z是该周期中金属性最强的元素,W的单质是黑火药的重要成分,含有该单质的某种膏药可治疗某些皮肤病.请回答下列问题:
X,Y,Z,W为按原子序数由小到大排列的四种短周期的元素,X的阳离子为质子,Y原子有3个能级,各能级电子数相等,Z,W位于同一周期,Z是该周期中金属性最强的元素,W的单质是黑火药的重要成分,含有该单质的某种膏药可治疗某些皮肤病.请回答下列问题: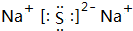 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
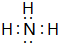 ,空间结构为三角锥形.
,空间结构为三角锥形.查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 在0~a范围内,只发生中和反应 | |
| B. | ab段发生反应的离子方程式为CO32-+2H+═H2O+CO2 | |
| C. | 原混合溶液中NaOH和Na2CO3的物质的量浓度之比为2:1 | |
| D. | c点对应的溶液中还能大量存在Fe2+、NO3-离子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 质子数为60 | B. | 原子序数为27 | C. | 中子数为27 | D. | 核外电子数为33 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 相对分子质量 | 密度/(g•cm-3) | 沸点/℃ | 水中溶解度 | |
| 乙醇 | 46 | 0.789 | 78.3 | 溶 |
| 乙酸 | 60 | 1.0492 | 118 | 溶 |
| 乙酸乙酯 | 88 | 0.897 | 77 | 微溶 |
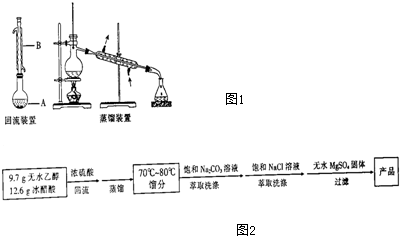
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
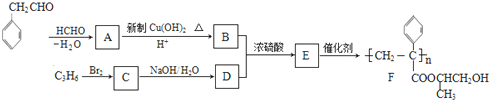
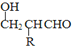 $\stackrel{-H_{2}O}{→}$
$\stackrel{-H_{2}O}{→}$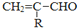
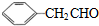 的相对分子质量大2,则符合下列条件的G的同分异构体有3种.
的相对分子质量大2,则符合下列条件的G的同分异构体有3种.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com