
| A. | 7.8 g Na2O2固体中所含离子数为0.4NA | |
| B. | 12g金刚石中含有的C-C键个数为1.5NA | |
| C. | 124 g P4含有的P-P键个数为6NA | |
| D. | 60 g SiO2中含Si-O键的个数为2NA |
分析 A、求出过氧化钠的物质的量,然后根据过氧化钠由2个钠离子和1个过氧根构成来分析;
B、求出金刚石的物质的量,然后根据金刚石中含2条C-C键来分析;
C、求出白磷的物质的量,然后根据白磷中含6条P-P键来分析;
D、求出二氧化硅的物质的量,然后根据二氧化硅中含4条硅氧键来分析.
解答 解:A、7.8g过氧化钠的物质的量为0.1mol,而过氧化钠由2个钠离子和1个过氧根构成,故0.1mol过氧化钠中含0.3NA个离子,故A错误;
B、12g金刚石的物质的量为1mol,而金刚石中含2条C-C键,故1mol金刚石中含2NA条碳碳键,故B错误;
C、124g白磷的物质的量为1mol,而白磷为正四面体结构,含6条P-P键,故1mol白磷中含6NA条P-P键,故C正确;
D、60g二氧化硅的物质的量为1mol,而二氧化硅中含4条硅氧键,故1mol二氧化硅中含4NA条硅氧键,故D错误.
故选C.
点评 本题考查了阿伏伽德罗常数的有关计算,难度不大,应注意掌握公式的运用和物质的结构.


 口算心算速算应用题系列答案
口算心算速算应用题系列答案 同步拓展阅读系列答案
同步拓展阅读系列答案科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 绿色化学的核心是对环境污染进行综合治理 | |
| B. | Al2O3可用作耐火材料 | |
| C. | 地沟油经处理后可用作燃料油 | |
| D. | 胶体和溶液的本质区别是分散质粒子直径大小 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
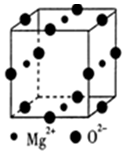 碱土金属指II A族的铍(Be)、镁(Mg)、钙(Ca)、锶(Sr)、钡(Ba)等元素,它们的单质及其化合物有着广泛的用途.
碱土金属指II A族的铍(Be)、镁(Mg)、钙(Ca)、锶(Sr)、钡(Ba)等元素,它们的单质及其化合物有着广泛的用途.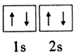 ;镁和铝的笫二电离能:I2(Mg)<I2(Al) (填“>”“<”或“=”).
;镁和铝的笫二电离能:I2(Mg)<I2(Al) (填“>”“<”或“=”).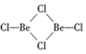 )的形式存在,在1000℃,氯化铍则以BeCl2形式存在.
)的形式存在,在1000℃,氯化铍则以BeCl2形式存在.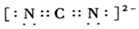 .
.查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:实验题
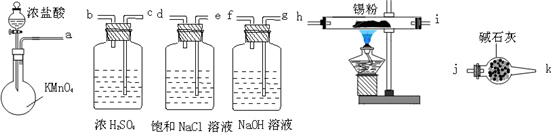
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 分子越稳定,其熔沸点越高 | |
| B. | HF的热稳定性很好,是因为HF分子间存在氢键 | |
| C. | 放热反应都不需要加热就可以进行 | |
| D. | 吸热反应不一定需要加热条件 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com